主な違い – モル質量と分子量
分子は、同じ原子または異なる原子が異なる比率で組み合わされて形成される物質です。これらの分子は互いに結合して化合物を形成することができます。ほとんどすべての化学反応が関与しており、分子または化合物に変化が生じます。したがって、化学反応を行い、最終生成物を予測するためには、分子の化学的および物理的特性を理解することが非常に重要です。モル質量と分子量は、物質の 2 つの物理的特性です。モル質量と分子量の主な違いは、モル質量は特定の物質のモルの質量を与えることです。 一方、分子量は特定の物質の分子の質量です。
対象となる主な分野
1.モル質量とは
– 定義、式、単位、計算
2.分子量とは
– 定義、式、単位、計算
3.モル質量と分子量の違いは何ですか
– 主な違いの比較
重要な用語:原子、炭素、同位体、モル質量、モル、分子量

モル質量とは
モル質量は、特定の物質のモルの質量です。物質の物性です。モル質量は、特定の物質の質量をその量で割ることによって得られます。 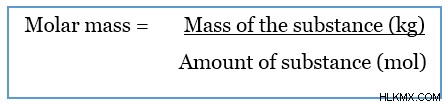
モル質量の SI 単位は kgmol または kg/mol です。しかし、一般に、それは gmol または g/mol の単位で与えられます。
元素のモル質量は、その元素の原子質量です。したがって、物質のモル質量は、その分子に存在する各元素の原子質量を加算することで計算できます。
モル質量の計算
H2 のモル質量を計算してみましょう 化合物よ。
H2 お:
- 存在する水素原子の数 =2
- 水素の原子量 =1.00794 g/mol
- 存在する酸素原子の数 =1
- 酸素の原子量 =15.999 g/mol
- したがって、H2 のモル質量は O =(2 x 1.00794 g/mol) + (1 x 15.999 g/mol)
=18.01488 g/mol
この簡単な計算は、H2 の 1 モルの質量が Oコンパウンドは18gです。
分子量とは
分子量という用語は、分子の質量として定義できます。 相対分子量とも呼ばれます .これは、分子量が炭素 12 同位体に対する質量として計算されるためです。
Aと呼ばれる仮想分子を考えると、 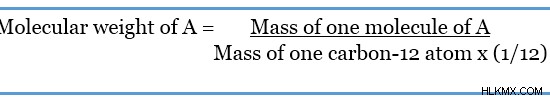
上の式は、分子量に単位がないことを示しています。これは、同じ単位を持つ 2 つの質量の間で除算が行われるためです。したがって、分子量は原子質量単位または amu として与えられます。上記の式を使用して、元素または化合物の分子量を見つけることができます。したがって、モル質量と同じように、特定の分子の分子量は各元素の原子質量の合計に等しくなります。
分子量の計算
同じ例 H2 を考えると おお、
- 存在する水素原子の数 =2
- 存在する酸素原子の数 =1
- 水素原子の質量 =1.00794 amu
- 酸素原子の質量 =15.999 amu
- したがって、H2 の分子量は O =(2 x 1.00794 amu) + (1 x 15.999 amu)
=18.01488 amu
これは、モル質量と分子質量の値は同じですが、単位が異なることを示しています。
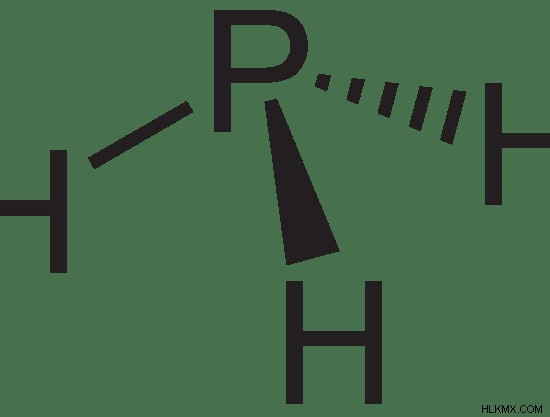
図 1:ホスフィン。ホスフィンのモル質量は 33.99758 g/mol です。分子量は 33.99758 amu です。
モル質量と分子量の違い
定義
モル質量: モル質量は、特定の物質のモルの質量です。
分子量: 分子量という用語は、分子の質量として定義できます。
ユニット
モル質量: モル質量の単位は kgmol-1 (または kg/mol) です。
分子量: 分子量には単位はありませんが、amu (または原子質量単位) として与えられます。
計算
モル質量: モル質量は、物質の質量を物質の量で割ることによって計算されます。
分子量: 分子量は、炭素 12 原子の質量の 1/12 に対する物質の質量として計算されます。
結論
モル質量と分子量の主な違いは、モル質量は特定の物質のモルの質量を与えるのに対し、分子量は特定の物質の分子の質量であることです。モル質量と分子量は定義と単位が異なりますが、値は同じです。それらは物質の物理的特性であり、化学分析技術に非常に役立ちます。