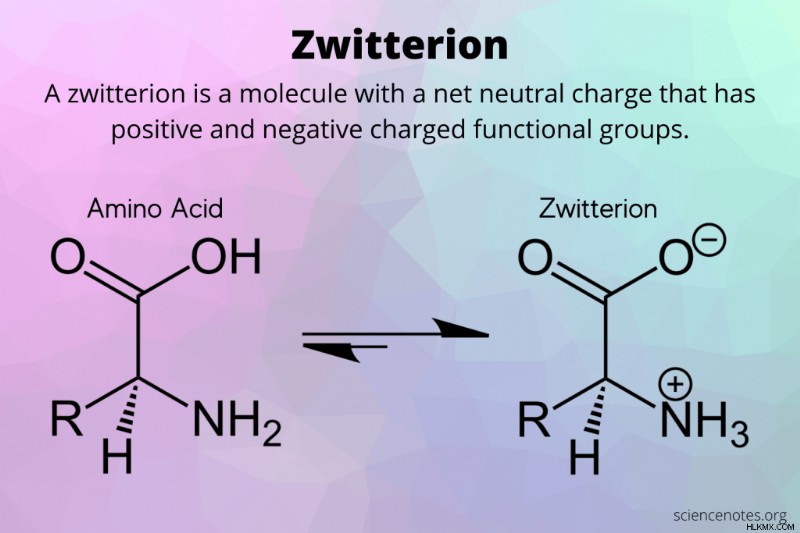
化学では、両性イオン 正と負に帯電した官能基を同数持つ中性分子です。荷電した官能基は、共有結合によって分子の残りの部分に接続します。
両性イオンの定義
両性イオンの定義は、ドイツ語の Zwitter に由来します。 、これは「ハイブリッド」または「雌雄同体」を意味します。名前は、両性イオンが正と負の電荷の等しい領域を持っていることを反映しています。両性イオンは、「内部塩」という名前で呼ばれることがあります。しかし、塩にはイオン結合が含まれるのに対し、両性イオンには共有結合が含まれるため、この名前は混乱を招く可能性があります.
一部の分子は、特定の pH 範囲内でのみ両性イオンになります。他の分子は双性イオンとしてのみ存在し、無電荷の官能基を持つことはありません。これらの化合物は永久両性イオンと呼ばれます .
両性イオンの例
- アミノ酸 :両性イオンの最もよく知られた例はアミノ酸です。アミノ酸は、アミノ基とカルボキシル官能基を持っています。アミノ酸自体は両性イオンではありませんが、水溶液中でアミノ基はプロトン (水素原子) を獲得して正電荷を持ち、カルボキシル基はプロトンを失って負電荷を獲得します。これは異性化反応で起こります。両性イオンは全体的に中性ですが、同等で反対の荷電官能基を持っています。水中の中性 pH では、「親」アミノ酸とその両性イオンの間に平衡が存在します。
H2 N(R)CO2 ち ↔ H3 N(R)CO2 + H2 〇
低い pH では、アミノ酸はカチオンを形成します。高い pH では、陰イオンを形成します。 - ベタイン :ベタインは永久双性イオンです。ベタインの例は、トリメチルグリシンとコカミドプロピル ベタインです。
- スルファミン酸 :アミノ酸と同様に、スルファミン酸はすべて中性型と双性イオン型で存在します。スルファミン酸は双性イオンの形で結晶化します。
- アントラニル酸 :アントラニル酸結晶には、親分子と両性イオンが同量含まれています。
- サイロシビン
- ホスファチジルコリン
そうでないもの ツイッテリオン?
双性イオンとは何かを理解するには、双性イオンでないものの例を見ると役立ちます。部分電荷の領域を持つ分子は両性イオンではありません。塩は両性イオンではありません。両性イオンではない化合物の例には、次のものがあります。
- 水 (H2 O) :水は中性の共有結合化合物ですが、水素原子と酸素原子は部分電荷のみの領域です。水は自己解離し、別個のヒドロニウムイオンと水酸化物イオンを形成します。
- 塩化ナトリウム (NaCl) :塩化ナトリウムなどの塩は、イオン結合でつながっているため双性イオンではありません。さらに、正電荷と負電荷の領域を持つ分子を形成するのではなく、水中で解離します。
- 塩化アンモニウム (NH4 Cl) :塩化アンモニウムはアンモニウム カチオン内に共有結合を含んでいますが、アンモニウムはイオン結合を介して塩化物に結合します。塩化アンモニウムは、荷電領域を持つ中性分子を形成するのではなく、水中で解離します。
両性イオンの性質
双性イオンは特定の特性を示します:
- 双性イオンは中性ですが、正と負の両方の電荷領域があります。
- 両性イオンには共有結合が含まれています
- 多くは、酸性官能基と塩基性官能基の両方を持つ両性電解質から形成されます。
- 両性イオンは、同じサイズの他の分子よりも高い融点を持つ傾向があります。荷電領域は他の分子を強く引き付けるため、それらを分離するにはより多くのエネルギーが必要です。
- アミノ酸などの両性イオンは、等電点 (pI) を持っています。これは、分子が中性電荷を持つ pH 値です。
両性イオンの重要性
両性イオンは、商業的にも自然界でも重要な用途を持っています:
- 生化学 :例えば、ホスファチジルコリンは、細胞膜の重要な成分であるリン脂質です。荷電領域は、分子に疎水性と親水性の両方の特性を与えます。
- 薬とサプリメント :多くのアルカロイドは両性イオンです。それらの薬理学は、それらの特性に依存します。 L-リジンなどの一部のサプリメントは両性イオンです。両性イオンは、センサーや医療用インプラントで重要です。
- バッファ :一部のバッファーは、MOPS や HEPES などの両性イオンです。これらのバッファーは細胞膜を透過しません。
- 分子生物学 :双性イオンは、SDS PAGE (ドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動) で使用されます。ここでの主な用途は、タンパク質の分離です。
- コーティング :両性イオンは、細菌やその他の生物が表面に定着するのを防ぎます。このようなコーティングは、医療や海洋産業で行われます。
参考文献
- Jensen, Jan H.;ゴードン、マーク S. (1995)。 「グリシン両性イオンを安定化するために必要な水分子の数について」。 アメリカ化学会誌 . 117 (31):8159–8170。 doi:10.1021/ja00136a013
- ネルソン、D.L.;コックス、MM(2000)。 レーニンガー、生化学の原理 (第3版)。ニューヨーク:出版する価値があります。 ISBN 1-57259-153-6.
- プライス、ウィリアム D.; Jockusch、Rebecca A.;ウィリアムズ、エヴァン R. (1997)。 「アルギニンはガス相で双性イオンですか?」. アメリカ化学会誌 . 119 (49):11988–11989. doi:10.1021/ja9711627. PMC 1364450
- Skoog, Douglas, A.;西、ドナルドM.;ホラー、F.ジェームス。 Crouch、Stanley R. (2004)。 分析化学の基礎 (第8版)。トムソン/ブルックス/コール。 ISBN 0-03-035523-0.