コア コンセプト
このチュートリアルでは、元素と化合物の正しいルイス ドット構造を描画する方法を学習します。さらに、価電子とオクテット規則について学びます。
他の記事で扱っているトピック
- 多原子イオン
- 電子
- 定期的な傾向
- 共鳴構造
語彙
- 価電子:原子の最外殻にある電子。
- オクテット ルール:元素は 8 つの価電子を持つことを好み、それに応じて結合します。
- グループ番号:周期の先頭に沿って並び、同じ化学反応性を持つ原子を含む番号。
ルイス構造とは?
1916 年、アメリカの化学者、ギルバート N. ルイスは、結合線を電子ドット構造に導入しました。ルイス構造または電子ドット構造とも呼ばれるこれらの構造は、電子がどのように共有され、原子の周りに配置されるかを視覚的に示す図です。点で示した電子は孤立電子対と呼ばれ、個々の原子に属します。線として示されている電子は結合であり、2 つの原子間で 2 つの電子が共有されていることを示しています。
ルイス ドット構造の作成方法
1.価電子の総数を求めてください。
ルイス構造を描くには、存在する価電子の総数を知る必要があります。個々の原子の価電子の数は、周期表の原子のグループ番号に基づいて見つけることができます。以下は、グループ番号を価電子に対応付けた表です。遷移金属であるグループ 3 ~ 12 は、4s 軌道殻が満たされているため、2 つの価電子のみを持ちます。グループ 18 は希ガスであり、完全なオクテットになります。
| グループ番号 | 1 | 2 | 3-12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 価電子の数 | 1 | 2 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
複数の原子のルイス構造を描く場合は、それらを足し合わせる必要があります。例:
<オール>- 酸素は、原子あたり 6 つの価電子を提供します。酸素原子が 3 つあるため、18 個の価電子が存在します。
- ナトリウムは 1 つの電子を提供します。
- 塩素は 7 個の電子を提供します。
- 窒素は 5 つの価電子を提供します。
- 4 つの原子があり、それぞれが 1 つの電子を与えるため、水素は 4 つの価電子を提供します。
- 最後に、正の電荷があるので、価電子を 1 つ引きます。マイナスの場合は 1 を加算します。
2.中心原子を決定
存在する価電子の数がわかったら、中心原子を決定する必要があります。中心原子には、いくつかの重要な特徴があります。まず、最も多くの結合を作ることができるのは原子であるため、中心にあるのに理想的です。 .通常、それは 1 つしか存在しない原子でもあり、最小の電気陰性度です。 原子。ここで、電気陰性度の周期的な傾向を見つけることができます。フッ素を中心原子と見なすことはありません。
3.原子間に単結合を形成し、残りの電子を孤立電子対として原子に配置します。
存在する価電子の数と、他の原子に対する原子の位置がわかったら、単結合の形成を開始できます。各原子に単結合ができたら、残りの数の価電子を原子に配置します。各点は電子であり、各線は 2 つの電子を表すことに注意してください。正しい数の電子を引き出すことが重要です。正しい量であることを確認するには、引き出された電子の数を数え、以前に計算された全価電子と比較してください。
4.オクテット規則に準拠するように電子を移動します。
正しい数の電子が原子に配置されたので、それらを動かして二重結合または三重結合を形成します。これは、各原子が 8 個の電子で満たされた原子価殻を持ちたいために行われます。これをオクテット規則と呼びます。さらに、一部の原子には、形成したい結合の数が設定されています。以下は、これを示す表です。
| Atom | カーボン | 窒素 | 酸素 | フッ素 |
| 債券数 | 4 | 3 | 2 | 1 |
| 孤立ペアの数 | 0 | 1 | 2 | 3 |
実践例:ルイス構造の描き方
ホウ素のルイスドット構造とは?

ドットを配置するときは、4 つのスポットがすべて埋まるまで、別々の側面にドットを描画することから始めます。それらがすべて塗りつぶされたら、同じ側にさらにドットを追加できます。ホウ素には 3 つの価電子があるため、3 つのドットがすべて異なる側に配置されます
臭化水素 (HBr) のルイス ドット構造は?

電子の総数は 8 になります。水素と臭素をつなぐ単結合があります。水素は 2 つの電子だけで満たされるため、残りの孤立電子対は最終的に臭素になります。
四塩化炭素 (CCl4) のルイスドット構造は何ですか? )?
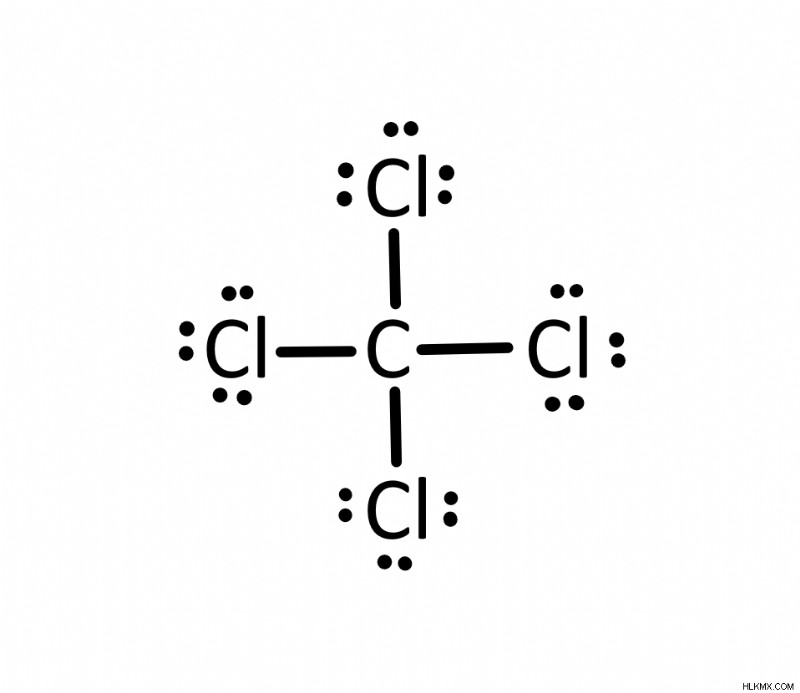
四塩化炭素には全部で 32 個の価電子があります。さらに、炭素は中心原子になります。炭素を塩素に接続する 4 つの単結合があります。炭素は 4 つの結合を持っているため、オクテット規則によって満たされます。残りの電子は最終的に塩素原子になります。
もっと例が必要ですか?これがワークシートです







