主な違い - pKa と pH
物理化学では、pKa と pH は系の酸性度に関連する 2 つの用語です。これらは対数値です。非常に大きい量または非常に小さい量を表現して比較する最も簡単な方法は、対数値を取ることです。対数は、非常に扱いやすい単純な値を与えます。 pKa と pH の主な違いは、pKa は酸の解離を示し、pH は系の酸性度またはアルカリ性を示すことです。
対象となる主な分野
1. pKaとは
– 定義、価値、関係
2. pHとは
– 定義、価値、関係
3. pKaとpHの違いは何ですか
– 主な違いの比較
重要な用語:酸性度、酸解離定数、塩基性度、pH、pKa

pKaとは
pKa は、Ka の対数の負の値です。 Ka は 酸解離定数 の記号です .酸には強酸もあれば弱酸もあります。強酸は、水溶液中にあると完全にイオンに解離します。しかし、弱酸は部分的に解離し、酸とその共役塩基の間に平衡が生じます。たとえば、HA という名前の弱酸を考えると、その解離は次のように与えられます。 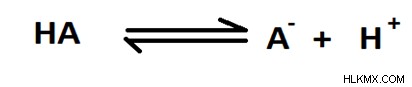
この平衡の酸解離定数は、
Ka =[A][H]/[HA]
ここで、
[A] =共役塩基の濃度
[H] =H+ イオンの濃度
[HA] =存在する酸の濃度
すると、酸解離定数のpKa値は以下のように表せます。
pKa =– log10 [Ka]
pKa値を見ると、酸が強酸か弱酸かがわかります。 pKaの値が高ければ酸が弱い。これは、pKa 値が高いほど Ka が低いことを示しているためです。 Ka の値を低くするために、[ A][H] の値は [HA] の値よりも低くする必要があります。これは、酸が部分的に解離したことを意味します。しかし、 [ の値が A][H] が [HA] より高い場合、Ka は高くなり、それに応じて pKa は低くなります。これは強酸であることを示しています。
pHとは
pH は、H 濃度の逆数の対数値です。 pH値は、システムの酸性度またはアルカリ性を示します。特定のシステムの pH 値が高い場合、それはアルカリ性または塩基性システムと呼ばれます。システムの pH 値が低い場合、そのシステムは酸性です。 pH の範囲は 1 ~ 14 です。pH 値 7 は、酸性またはアルカリ性が存在しない中性 pH であることが知られています。 pH と pKa の関係は次のようになります。 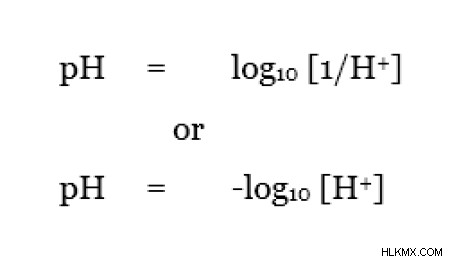
分析化学では、特定の反応の終点を特定するために pH 指示薬が使用されます。これらの指示薬は pH の変化に非常に敏感で、水溶液中の異なる pH 値に対して異なる色を示します。
しかし、pH 値は、水域の酸性度またはアルカリ度の良い指標です。 pH メーターは、水またはその他の溶液の pH を測定するために使用できます。
pKa と pH の違い
定義
pKa: pKa は、Ka の対数の負の値です。
pH: pH は H 濃度の逆数の対数値です。
酸味の目安
pKa: pKa は、酸が強酸か弱酸かを示します。
pH: pH は、システムが酸性かアルカリ性かを示します。
与えられた詳細
pKa: pKa は、水溶液中の酸の解離の詳細を示します。
pH: pH は、システム内の H イオンの濃度に関する詳細を示します。
値
pKa: 酸の pKa が高い場合、それは弱酸であり、酸の pKa が低い場合、それは強酸です。
pH: システムの pH が高い場合、システムはアルカリ性ですが、pH が低い場合、そのシステムは酸性です。
他のパラメータの影響
pKa: pKa は、酸、共役塩基、および H の濃度に依存します。
pH: pH は H 濃度に依存します。
結論
pKa と pH は両方とも、実験室での実践において非常に重要なパラメーターです。 pKa と pH の主な違いは、pKa は酸の解離を示し、pH は系の酸性度またはアルカリ性度を示すことです。







