主な違い - 硫黄と硫酸塩
地球上の硫黄の存在量は 0.042% と決定されています。酸素やケイ素などの元素に比べると微量ですが、地球上で13番目に多い元素です。硫酸塩は、硫黄原子で構成される陰イオンです。しかし、硫黄と硫酸塩には明確な違いがあります。硫黄と硫酸塩の主な違いは、硫黄が元素であるのに対し、硫酸塩は陰イオンであることです。
対象となる主な分野
1.硫黄とは
– 化学的および物理的性質、同素体
2.硫酸塩とは
– 化学的および物理的特性
3.硫黄と硫酸塩の違いは何ですか
– 主な違いの比較
重要な用語:同素体、非金属、単斜晶系硫黄、 斜方晶系硫黄、菱形硫黄、ケイ素、硫酸塩、硫黄、原子価 
硫黄とは
硫黄は元素です。硫黄の原子番号は記号「S」の 16 で、硫黄の電子配置は 1s2s2p3s3p です。この元素の最も外側の電子を含む軌道は p 軌道です。したがって、硫黄は p ブロックにグループ化されます。硫黄の電子配置によると、硫黄の原子価は6です。つまり、硫黄の周りに最大6つの結合を形成できます。したがって、硫黄は+6までの酸化状態を持つことができます。しかし、場合によっては、硫黄がさらに 2 つの電子を獲得して p 軌道を埋め、酸化状態 -2 になることがあります。
通常、硫黄は室温で固体です。しかし、この固体には純粋な硫黄原子は含まれていません。ほとんどの場合、硫黄固体は S8 から作られています ユニット。これらは硫黄結晶と呼ばれます。 1 つの S8 ユニットは8個の硫黄原子で構成されています。環状構造であり、非常に安定しています。固体硫黄は明るい黄色で表示されます。

図 1:硫黄結晶
硫黄の融点は約 115℃です。硫黄の原子量は 32 g/mol です。硫黄は非金属です。硫黄固体は結晶でできているため、脆い構造です。ただし、硫黄は水に溶けません。
硫黄には多くの同素体があります。これらの硫黄の同素体は、硫黄原子の組成と構造によって互いに異なります。一般的な同素体の一部を以下に示します。
硫黄の同素体
斜方晶系硫黄
S8 ユニットは「クラウン」構造です。
菱形硫黄
これは安定した固体で、S8 で構成されています ユニット。 S8 の形状 単位は菱形です。
単斜晶系硫黄
これらは針状の構造です。
しかし、硫黄のサンプルをゆっくりと着実に加熱することで、ある同素体から別の同素体を簡単に取得できます。
硫酸塩とは
硫酸塩は、硫黄原子と 4 つの酸素原子で構成される陰イオンです。この陰イオンの総電荷は -2 です。硫酸塩の分子式はSO4 .そこでは、2つの酸素原子が二重結合を介して硫黄原子に結合し、他の2つは単結合を介して硫黄原子に結合しています。硫酸塩中の硫黄の酸化状態は+6です。これは、硫黄が持つことができる最大の酸化状態です。したがって、硫酸塩は酸化反応を受けることができません。
しかし、硫酸塩の結合長を実験的に求めると、すべての結合長が同じであることがわかりました。したがって、硫酸塩が共鳴構造を持っていることを示しています。
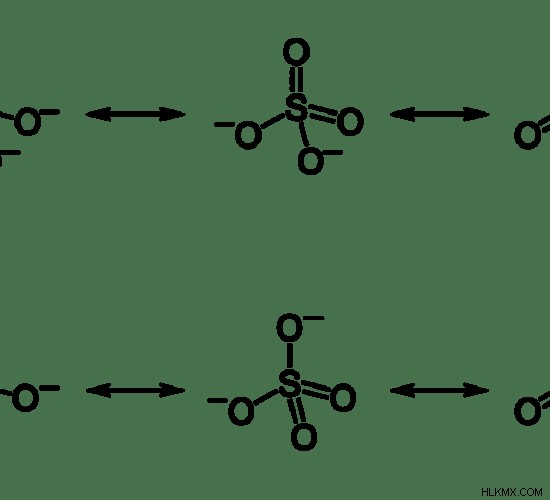
図 2:硫酸塩の共鳴構造
硫酸陰イオンのモル質量は約 96 g/mol です。ほとんどの硫酸化合物は水に溶けます。しかし、一部の硫酸塩は溶解度が低いか、まったく溶解しません。たとえば、BaSO4 (硫酸バリウム)は水に溶けません。硫酸化合物には無色のものもあれば、水中にあると非常にカラフルなものもあります。たとえば、CuSO4 (硫酸銅) は、水溶液の場合は明るい青色ですが、水分子が存在しない場合は白色です。
硫黄と硫酸塩の違い
定義
硫黄: 硫黄は記号 S を持つ元素です。
硫酸塩: 硫酸塩は、硫黄原子 (S) と 4 つの酸素原子 (O) で構成される陰イオンです。
質量
硫黄: 硫黄の原子質量は約 32 g/mol です。
硫酸塩: 硫酸塩のモル質量は約 96 g/mol です。
ジオメトリ
硫黄: 硫黄の形状は、斜方晶、菱形、または単斜晶になります。
硫酸塩: 硫酸塩の形状は四面体です。
構成
硫黄: 固体硫黄は S8 で構成されています
硫酸塩: 硫酸塩は、硫黄原子と酸素原子で構成されています。
融点
硫黄: 硫黄の融点は約115℃です。
硫酸塩: 硫酸塩の融点は、結合している陽イオンによって異なります。
電荷
硫黄: 硫黄は中性に帯電しています。
硫酸塩: 硫酸塩は負に帯電しています。
結論
硫黄原子は、さまざまな種類の化合物で、または硫黄同素体として見つかります。硫黄同素体は硫黄原子のみで構成されていますが、硫黄含有化合物は他の多くの元素で構成されています。硫黄と硫酸塩の主な違いは、硫黄が元素であるのに対し、硫酸塩は陰イオンであることです.