定期トレンドとは?
定期的な傾向 周期表での位置に依存する要素のプロパティの観察可能なパターンです。これらの傾向により、過去の科学者は未知の元素の特定の特性を予測することができました。これは、これらの傾向が起こることを可能にする期間または家族内にある構造的類似性の要素によるものです。電気陰性度、原子半径、第一イオン化エネルギー、反応性、電子親和力などの特性の傾向について説明します。
定期的な傾向を使用して識別できるプロパティはどれですか?
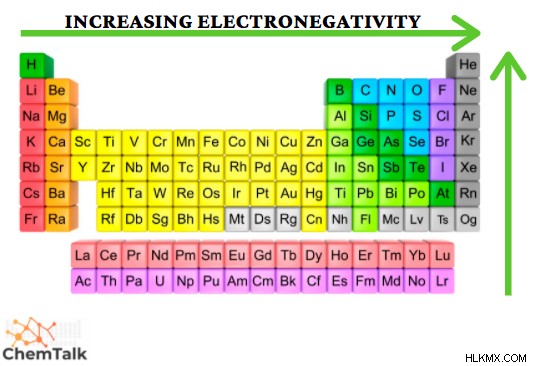
電気陰性度:
電気陰性度は、原子が電子を引き付けて結合を形成する傾向を測定する特性です。この性質を測るために作られた尺度がポーリング尺度です。これは、共有結合によって結合されたさまざまな要素の結合エネルギーを測定することによって作成されました。この尺度は 0.7 から 4.0 の範囲であり、セシウムは電気陰性度が最も低い元素であり、フッ素は電気陰性度が最も高い元素です。これは、期間のさらに右側、およびより高いグループが電気陰性度の値が増加することが観察されるため、周期的傾向を通じて観察されます。希ガスには電気陰性度がないことに注意してください。
イオン化エネルギー:
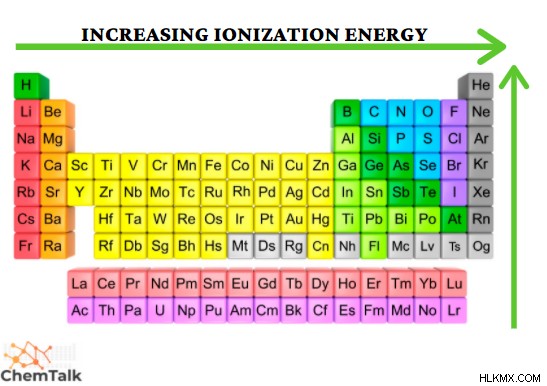
気相で中性原子の最も外側の電子殻から電子を除去するために必要な最小量のエネルギーは、イオン化エネルギーと呼ばれます .
この特性は、電子を除去することの難しさを表しています。イオン化エネルギーは、原子から強く束縛された電子を除去するために、より多くのエネルギーが必要になるため、期間のすぐ下でさらに増加し、グループが高くなるにつれて増加します。高いイオン化エネルギーの例はヘリウムで、核内に +2 電荷が存在する非常に小さな原子半径を持っています。これにより、これらの引力の結果として電子が保持されます。
反応性:
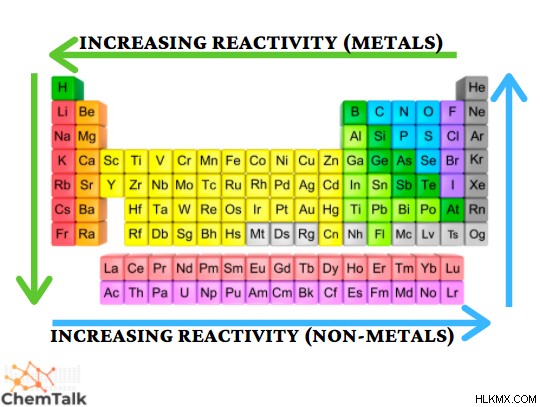
反応性とは、分子または原子が化学反応を起こし、続いてエネルギーを放出する能力を表します。この特性は、電気陰性度やイオン化エネルギーなどの特性に依存します。これらは、化学反応が受ける電子の相互作用に影響を与える要因です。反応性は、元素 (金属と非金属) の分類に依存します。どちらも周期的な傾向が異なるからです。金属の反応性は、期間に沿ってさらに左に、グループの下にさらに増加します。一方、非金属の反応性は、期間が進むにつれてさらに増加し、グループがさらに増加します。観測される最も反応性の高い元素は、空気や水と自発的に反応するセシウムです!
電子親和力:
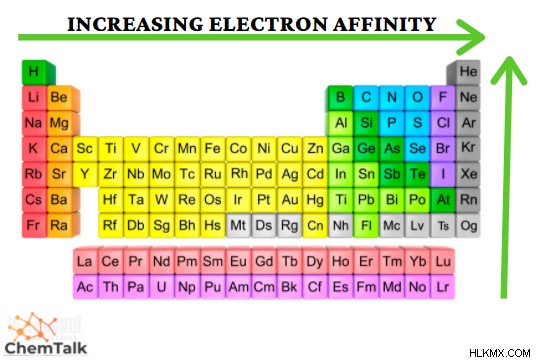
電子親和力は、負イオンを形成するために中性原子が電子を獲得する傾向を表す特性です。このプロセスでは、エネルギーが放出され、発熱プロセスとしても知られています (希ガスを除く)。周期がさらに右の元素ほど電子親和力が高くなるという傾向が見られます。これは、負イオンを形成する電子が外側の電子殻に追加され、電子と原子核の間の引力が増加するために見られます。この規則の例外は、電子親和力が最も高い元素である塩素です。これは、塩素が最も外側の軌道でフッ素よりも電子のためのスペースが大きいためです。塩素の軌道のスペースが大きいほど、塩素の電子が余分な電子とスペースを共有しやすくなり、電子親和力が増加します。
原子半径:
原子半径は、原子核とその最も外側の電子殻の間の距離を表す用語です。この距離にはいくつかの要因が影響します。元素の数と電子殻の数を含みます。周期的な傾向を通じて、原子半径は周期のさらに左のサイズで増加し、グループを下げます。このパターンに従って、セシウムは最大の原子半径を持つことが示されています。
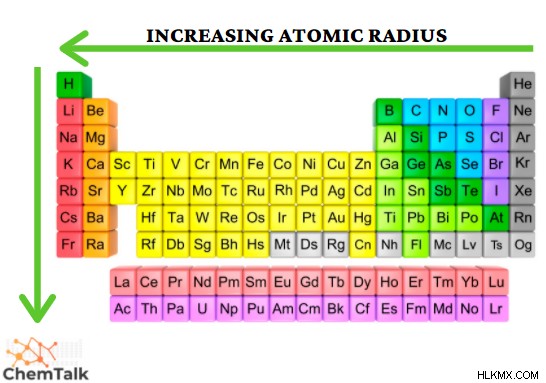
定期的な傾向:参考資料:
周期表の読み方
原子の構造
原子半径の傾向
原子番号







