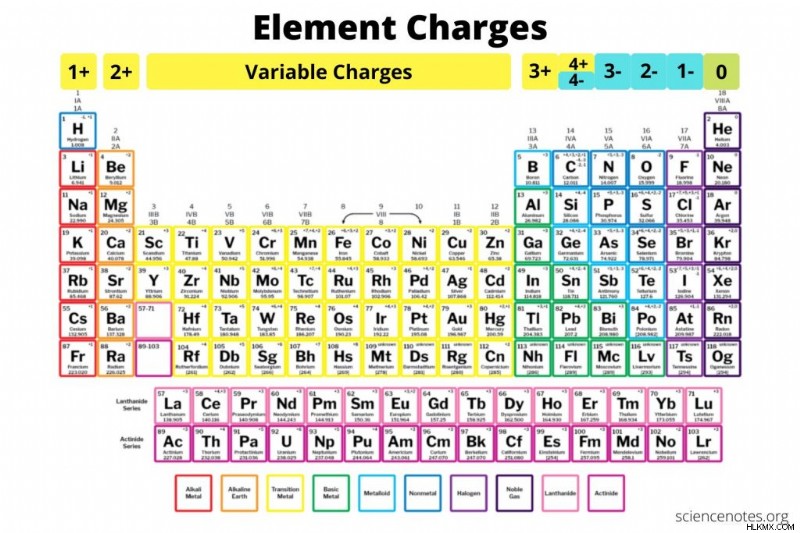
これは、要素の電荷の表と、要素の電荷がわからない場合の見つけ方の説明です。電荷、酸化状態、価数の違いも説明されています。これらの図と表を参照用にダウンロードして印刷できます。
元素の電荷を見つける方法
元素の電荷を見つける方法は 4 つあります:
<オール>グループ 1 (アルカリ金属) :1+
グループ 2 (アルカリ土類金属) :2+
グループ 3-12 (遷移金属) :可変正電荷
ランタニドおよびアクチニド シリーズ :可変正電荷
グループ 13 :3+
グループ 14 :4+ または 4-
グループ 15 :3-
グループ 16 :2-
グループ 17 (ハロゲン):1-
グループ 18 (希ガス):0
| Number | 要素 | チャージ |
|---|---|---|
| 1 | 水素 | 1+ |
| 2 | ヘリウム | 0 |
| 3 | リチウム | 1+ |
| 4 | ベリリウム | 2+ |
| 5 | ホウ素 | 3-、3+ |
| 6 | カーボン | 4+ |
| 7 | 窒素 | 3- |
| 8 | 酸素 | 2- |
| 9 | フッ素 | 1- |
| 10 | ネオン | 0 |
| 11 | ナトリウム | 1+ |
| 12 | マグネシウム | 2+ |
| 13 | アルミニウム | 3+ |
| 14 | シリコン | 4+、4- |
| 15 | リン | 5+、3+、3- |
| 16 | 硫黄 | 2-、2+、4+、6+ |
| 17 | 塩素 | 1- |
| 18 | アルゴン | 0 |
| 19 | カリウム | 1+ |
| 20 | カルシウム | 2+ |
| 21 | スカンジウム | 3+ |
| 22 | チタン | 4+、3+ |
| 23 | バナジウム | 2+、3+、4+、5+ |
| 24 | クロム | 2+、3+、6+ |
| 25 | マンガン | 2+、4+、7+ |
| 26 | 鉄 | 2+、3+ |
| 27 | コバルト | 2+、3+ |
| 28 | ニッケル | 2+ |
| 29 | 銅 | 1+、2+ |
| 30 | 亜鉛 | 2+ |
| 31 | ガリウム | 3+ |
| 32 | ゲルマニウム | 4-、2+、4+ |
| 33 | ヒ素 | 3-、3+、5+ |
| 34 | セレン | 2-、4+、6+ |
| 35 | 臭素 | 1-、1+、5+ |
| 36 | クリプトン | 0 |
| 37 | ルビジウム | 1+ |
| 38 | ストロンチウム | 2+ |
| 39 | イットリウム | 3+ |
| 40 | ジルコニウム | 4+ |
| 41 | ニオブ | 3+、5+ |
| 42 | モリブデン | 3+、6+ |
| 43 | テクネチウム | 6+ |
| 44 | ルテニウム | 3+、4+、8+ |
| 45 | ロジウム | 4+ |
| 46 | パラジウム | 2+、4+ |
| 47 | シルバー | 1+ |
| 48 | カドミウム | 2+ |
| 49 | インジウム | 3+ |
| 50 | スズ | 2+、4+ |
| 51 | アンチモン | 3-、3+、5+ |
| 52 | テルル | 2-、4+、6+ |
| 53 | ヨウ素 | 1- |
| 54 | キセノン | 0 |
| 55 | セシウム | 1+ |
| 56 | バリウム | 2+ |
| 57 | ランタン | 3+ |
| 58 | セリウム | 3+、4+ |
| 59 | プラセオジム | 3+ |
| 60 | ネオジム | 3+、4+ |
| 61 | プロメチウム | 3+ |
| 62 | サマリウム | 3+ |
| 63 | ユーロピウム | 3+ |
| 64 | ガドリニウム | 3+ |
| 65 | テルビウム | 3+、4+ |
| 66 | ジスプロシウム | 3+ |
| 67 | ホルミウム | 3+ |
| 68 | エルビウム | 3+ |
| 69 | ツリウム | 3+ |
| 70 | イッテルビウム | 3+ |
| 71 | ルテチウム | 3+ |
| 72 | ハフニウム | 4+ |
| 73 | タンタル | 5+ |
| 74 | タングステン | 6+ |
| 75 | レニウム | 2+、4+、6+、7+ |
| 76 | オスミウム | 3+、4+、6+、8+ |
| 77 | イリジウム | 3+、4+、6+ |
| 78 | プラチナ | 2+、4+、6+ |
| 79 | 金 | 1+、2+、3+ |
| 80 | 水銀 | 1+、2+ |
| 81 | タリウム | 1+、3+ |
| 82 | リード | 2+、4+ |
| 83 | ビスマス | 3+ |
| 84 | ポロニウム | 2+、4+ |
| 85 | アスタチン | ? |
| 86 | ラドン | 0 |
| 87 | フランシウム | ? |
| 88 | ラジウム | 2+ |
| 89 | アクチニウム | 3+ |
| 90 | トリウム | 4+ |
| 91 | プロタクチニウム | 5+ |
| 92 | ウラン | 3+、4+、6+ |


酸化数とは?
原子の電荷について話すとき、通常は原子価ではなく酸化数です。
電荷、原子価、および酸化状態
多くの文献では、電荷 (または形式電荷)、原子価、および酸化数という用語は同じ意味で使用されています。これら 3 つの用語は関連していますが、定義が少し異なります:
- 突撃(正式な突撃) :電荷は、配位子のすべてがホモリティックに除去されたときの原子の電荷です。ホモリティック切断では、結合を共有する電子が 2 つの原子間で均等に分割されます。
- 酸化状態(酸化数) :酸化状態は、すべての配位子がヘテロリティックに除去されたときの原子の電荷です。この場合、電気陰性度の高い原子が電子を受け取ります。
- ヴァランス :価数は、原子が化学結合を形成するために使用する電子の数です。
混乱している?通常、知りたいのは酸化状態で、数字と正または負の符号の両方が含まれます。たとえば、HCl では、H と Cl の両方が 1 の原子価を持ちます。各原子からの 1 つの電子が化学結合の形成に関与します。ただし、水素の酸化状態は +1 ですが、塩化物の酸化状態は -1 です。酸化状態から、電荷がわかります (またはその逆)。原子の電荷を H と Cl と書きます。
参考文献
- カレン、P.;マカードル、P。 Takats, J. (2016)。 「酸化状態の包括的な定義 (IUPAC 勧告 2016)」。 Pure Appl.化学 . 88 (8):831–839. doi:10.1515/pac-2015-1204
- Parkin、Gerard (2006 年 5 月)。 「原子価、酸化数、形式電荷:3 つの関連性はあるが根本的に異なる概念」. Journal of Chemical Education . 83 (5):791. doi:10.1021/ed083p791