主な違い - 一次とゼロ次の速度論
化学反応速度論は、化学反応の速度を表します。化学反応速度論の概念は、質量作用の法則によって最初に開発されました。質量作用の法則は、化学反応の速度が反応物の質量に比例することを示しています。化学反応速度論によると、反応はゼロ次反応、一次反応、二次反応に分類できます。 主な違い 一次速度論とゼロ次速度論の間の違いは、一次速度論の速度は 1 つの反応物の濃度に依存するのに対し、ゼロ次速度論の速度は反応物の濃度に依存しないことです。
対象となる主な分野
1.一次速度論とは
– 定義、プロパティ、例
2.ゼロオーダーキネティクスとは
– 定義、プロパティ、例
3.一次速度論とゼロ次速度論の違いは何ですか
– 主な相違点の比較
重要な用語:濃度、一次速度論、速度論、質量作用の法則、速度定数、速度法則、反応速度、ゼロ次速度論 
一次速度論とは
一次速度論とは、反応速度が 1 つの反応物のモル濃度に依存する化学反応を指します。反応速度は、1 つの反応物の濃度に比例します。化学反応に参加する他の多くの反応物が存在する可能性がありますが、反応速度を決定するのは 1 つの反応物だけです。したがって、他の反応物は、この特定の反応に関してゼロ次であることがわかっています。
たとえば、五酸化二窒素 (N2 O5 )。これは単分子反応です。つまり、この反応は1つの反応物のみで構成されています。反応速度は以下のように与えられます。
2N2 O5(g) → 4NO2(g) + O2(g)
レート =k[N2 O5(g) ]
k は速度定数で、[N2 O5(g) ] は N2 の濃度 O5(g) .文字「m」は、N2 の濃度に関する反応の順序を示します O5(g) .上記の式は率則として知られており、上記の式では m=1 です。次に、反応速度は以下のように与えられます。
レート =k[N2 O5(g ]
m の値は実験的に求めることができます。ここでは、値は常に 1 です。これは N2 の分解を示しています O5(g) 一次反応です。さらに、反応の順序は、反応物の化学量論係数と等しくても等しくなくてもよい。上記の例では、化学量論係数は 2 ですが、反応の次数は 1 です。一次反応の速度は、次のようにグラフで表すことができます。
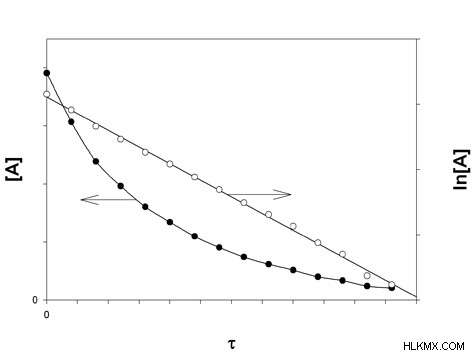
図 1:一次速度論のグラフ
上の図で、黒い点のあるグラフは、反応物濃度と反応時間のグラフです。反応物の濃度によって反応速度が変化することを示す曲線グラフです。白い点のグラフは、ln[反応物濃度] 対 反応時間のグラフを示します。線形グラフです。
ゼロ次速度論とは
ゼロ次動力学とは、反応速度が反応物の濃度に依存しない化学反応を指します。言い換えれば、反応物の濃度は反応速度に影響しません。したがって、温度が一定である限り、反応速度はゼロ次動力学で一定になります。
どのような反応物が存在し、それらの濃度がどの程度変化しても、反応速度は同じままです。したがって、反応速度は次のように与えられます。
レート =k
ここで、k は速度定数です。
ゼロ次反応の良い例は、触媒としての白金の存在下での亜酸化窒素の分解です。
2N2 O(g) → 2N2(g) + O2(g)
この反応の速度は、速度定数に等しいです。したがって、反応速度は以下のように与えられます。
レート =k[N2 O(g) ]
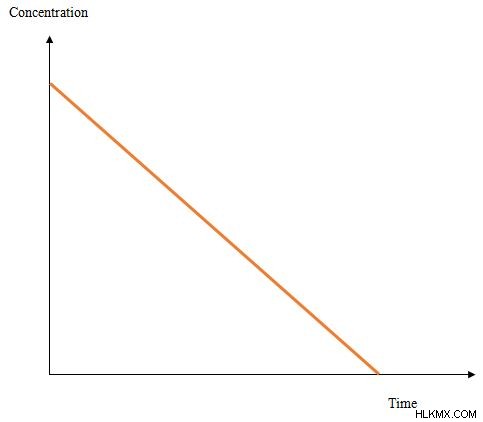
図 2:反応物濃度と反応時間のグラフ
上のグラフは、反応速度がゼロの場合の反応時間に対する反応物の濃度の変化を示しています。線形グラフです。
一次速度論とゼロ次速度論の違い
定義
一次速度論: 一次反応速度論とは、反応速度が 1 つの反応物のモル濃度に依存する化学反応を指します。
ゼロ次速度論: ゼロ次動力学とは、反応速度が反応物質の濃度に依存しない化学反応を指します。
反応物濃度対時間のグラフ
一次動力学: 一次速度論の反応物濃度対時間のグラフは曲線グラフです。
ゼロオーダーキネティクス: ゼロ次動力学の反応物濃度対時間のグラフは線形グラフです。
反応物濃度
一次動力学: 一次速度論的反応は、反応物の濃度に依存します。
ゼロオーダーキネティクス: ゼロ次速度論的反応は、反応物の濃度に依存しません。
料金法
一次速度論: 一次速度論的反応の速度法則には、速度定数に反応物濃度を掛けたものが含まれます。
ゼロオーダーキネティクス: ゼロ次速度論的反応の速度法則には、速度定数のみが含まれます。
結論
速度法則または速度方程式は、システムの化学動力学に関する最も重要な詳細を提供します。これは、一定温度での反応物濃度と速度定数に関する特定の反応の速度を表します。化学反応の速度論によると、反応には 3 つの主要なタイプがあります。それらはゼロ次反応、一次反応、二次反応です。これらの反応は、特定のシステムに存在する反応物に関する反応の順序によって互いに異なります。