主な違い – ヘンリーの法則とラウルの法則
Henry の法則と Raoult の法則はどちらも熱力学に見られる 2 つの法則であり、互いに平衡状態にある溶液とその蒸気との関係を表しています。ヘンリーの法則は、水などの液体溶媒への気体の溶解を説明するために使用できます。 Raoult の法則は、蒸気圧と平衡にある溶液中の溶媒の挙動を示します。ただし、これらの法則を実際のソリューションに適用する場合、特定の制限があります。ヘンリーの法則とラウルの法則の主な違いは、ヘンリの法則は溶液中の溶質の挙動を説明するのに対し、ラウルの法則は溶液中の溶媒の挙動を説明することです。
対象となる主な分野
1.ヘンリーの法則とは
– 例、制限付きの法律の説明
2.ラウールの法則とは
– 例、制限付きの法律の説明
3.ヘンリーの法則とラウルの法則の違いは何ですか
– 主な違いの比較
重要な用語:ヘンリーの法則、ラウールの法則、溶質、溶液、溶媒 
ヘンリーの法則とは
ヘンリーの法則は、気体が液体媒体に溶解することを説明する気体の法則です。この法則は、液体に溶解している気体の量は、液体と平衡状態にある気体の分圧に正比例すると述べています。これは以下の式で与えられます。
[A(aq) ] =kH .PA(g)
[A(aq)] ] は、溶液に溶解しているガス A の濃度です。
kH はヘンリーの法則定数です
PA(g) A(g) の分圧
ヘンリーの法則定数は比例定数であり、溶媒、溶質、および温度の種類に依存します。したがって、特定のガスの場合、ヘンリーの法則定数は温度によって異なる場合があります。したがって、気体の水への溶解度を計算するときは、その特定の温度におけるヘンリーの法則定数の値を取得する必要があります。
ガス | 25℃におけるヘンリーの法則定数 (mol/L atm) |
| O2 | 1.3×10 |
| N2 | 6.1×10 |
| H2 | 7.8×10 |
| CO2 | 3.4×10 |
表 01:大気中のさまざまなガスに対する 25℃ でのヘンリーの法則定数
さらに、特定の気体にヘンリーの法則を適用する場合、その温度での水の蒸気圧を考慮して分圧を求める必要があります。次の例を考えてみましょう。
例
質問: 通常の大気条件にある湖を考えてみましょう。 O2(g) の溶解度を決定する 大気中の水の蒸気圧を 0.0313atm として、温度 25℃、大気圧 1atm での値です。通常の空気は 21% の O2(g). で構成されています。

図 1:水域は、水の温度と大気圧に応じてさまざまな量で溶解したガスを含む水で構成されています。
答え:
大気中の酸素の部分的圧力=(1-0.0313)ATM X(21/100)
=0.20 atm
25oc =1.3 x 10mol /l atmでの酸素のヘンリーの法則定数
ヘンリーの法則の適用;
[O(aq) ] =kH.PO2 (g)
=1.3 x 10 mol/L atm x 0.2 atm
=2.6 x 10 mol/L
上記の計算によると、通常の温度および圧力条件での水域の溶存酸素量は非常に少ないです。
制限事項
ヘンリーの法則は、考慮される分子が平衡状態にある場合にのみ使用できます。さらに、この法則は高圧条件では機能しません。さらに、溶解ガスが溶媒と化学反応を示す場合、この法則はそのシステムには使用できません。
Raoult の法則とは
ラウールの法則は、溶液の蒸気圧とその溶液中の溶質の分圧との関係を説明する熱力学的法則です。この法則は、溶液上の溶媒の蒸気圧は、純粋な溶媒の (その温度での) 蒸気圧に溶媒のモル分率を掛けたものに等しいと述べています。
これは次の式で与えられます。
P溶質 =x溶質 x P溶質
ここで、PA は混合物中の成分 A の分圧、
xA 成分Aのモル分率、
PA は同じ温度での純成分の蒸気圧です。
たとえば、A と B の混合を考えてみましょう。ここでは、
A のモル分率 / (nA + nB )
A の分圧 / (nA + nB )} PA
したがって、その系の全蒸気圧 =PA + PB
しかし、ラウールの法則は理想的な解に対してのみ機能します。理想的な溶液は、溶質分子間の分子間相互作用が溶媒分子の分子間相互作用と等しい溶質で構成されています。理想気体と見なすことができる実際の溶液は存在しないため、溶質分子の量が少ない非常に希薄な溶液にこの法則を適用できます。
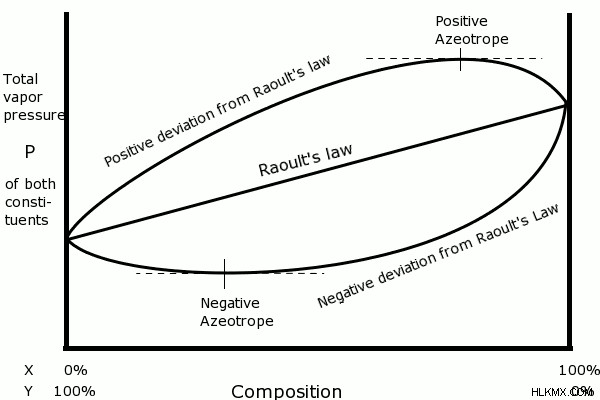
図 2:X ガスと Y ガスで構成されるガス混合物に対するラウールの法則の適用
制限事項
溶質のモル分率を計算するときは、添加した化合物のモル数ではなく、溶液中に存在する粒子のモル数を考慮する必要があります。たとえば、イオン性化合物が水に溶解している場合、溶液中で分離されている各イオンは 1 つの粒子と見なす必要があります (例:NaCl は Na+ および Cl- イオンを生成します。したがって、存在する粒子の量は、 NaCl が追加されました。)
ヘンリーの法則とラウルの法則の違い
定義
ヘンリーの法則: ヘンリーの法則は、液体媒体への気体の溶解を説明する熱力学的法則です。
ラウルの法則: Raoult の法則は、溶液の蒸気圧とその溶液中の溶質の分圧との関係を説明する熱力学的法則です。
コンセプト
ヘンリーの法則: ヘンリーの法則は、液体に溶解している気体の量は、液体と平衡状態にある気体の分圧に正比例すると述べています。
ラウルの法則: Raoult の法則では、溶液上の溶媒の蒸気圧は、(その温度での) 純粋な溶媒の蒸気圧に溶媒のモル分率を掛けた値に等しいと述べています。
比例定数
ヘンリーの法則: ヘンリーの法則における比例定数は、ヘンリーの法則定数と呼ばれます。
ラウールの法則: Raoult の法則は比例定数を使用しません。
結論
ヘンリーの法則とラウールの法則は、蒸気圧と接触している溶液の化学的挙動を示しています。ヘンリーの法則とラウルの法則の違いは、ヘンリーの法則は溶液中の溶質の挙動を説明するのに対し、ラウルの法則は溶液中の溶媒の挙動を説明することです.