主な違い – 第一イオン化エネルギーと第二イオン化エネルギー
イオン化エネルギーは、気体原子が最も外側の軌道から電子を取り除くために必要なエネルギー量です。これがイオン化エネルギーです。これは、原子が電子を除去した後に正電荷を取得し、正電荷を帯びたイオンになるためです。すべての化学元素には、特定のイオン化エネルギー値があります。これは、ある元素の原子が別の元素の原子と異なるためです。第 1 イオン化エネルギーと第 2 イオン化エネルギーは、それぞれ 1 つの電子と別の電子を除去するために原子が必要とするエネルギーの量を表します。第 1 イオン化エネルギーと第 2 イオン化エネルギーの主な違いは、 特定の元素の第 1 イオン化エネルギーは、第 2 イオン化エネルギーよりも小さい値を持ちます。
対象となる主な分野
1.第一イオン化エネルギーとは
–定義、周期表の傾向
2.第二イオン化エネルギーとは
–定義、周期表の傾向
3.第 1 イオン化エネルギーと第 2 イオン化エネルギーの違いは何ですか
– 主な違いの比較
重要な用語:第一イオン化エネルギー、イオン化、第二イオン化エネルギー、シェル 
第一イオン化エネルギーとは
第一イオン化エネルギーは、ガス状の中性原子が最も外側の電子を取り除くために必要なエネルギー量です。この最も外側の電子は、原子の最も外側の軌道にあります。したがって、この電子は、その原子の他の電子の中で最も高いエネルギーを持っています。したがって、最初のイオン化エネルギーは、原子から最高エネルギーの電子を放出するのに必要なエネルギーです。この反応は本質的に吸熱反応です。これは、次のような反応で与えられます。
X(g) → X(g) + e
この概念は中性荷電原子に関連付けられています。これは、中性荷電原子は、要素を構成する元の数の電子のみで構成されているためです。ただし、そのために必要なエネルギーは元素の種類によって異なります。すべての電子が原子内で対になっている場合、より高いエネルギーが必要です。不対電子がある場合、それはより低いエネルギーを必要とします。ただし、値は他のいくつかの事実にも依存します。たとえば、原子半径が大きい場合、最も外側の電子が原子核から遠く離れているため、必要なエネルギー量は低くなります。すると、この電子と原子核の間の引力は低くなります。そのため、簡単に取り外すことができます。しかし、原子半径が小さい場合、電子は原子核に強く引き付けられます。そうすると、原子から取り除かれにくくなります。
元素の周期表は、その周期を通じて最初のイオン化エネルギーを変化させる特定のパターンまたは傾向を示しています。周期表のグループを下に移動すると、原子半径がグループの下に増加するため、最初のイオン化エネルギーが減少します。
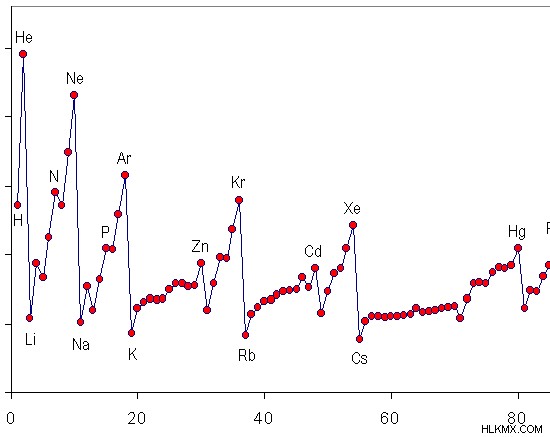
図 1:元素の周期表における第一イオン化エネルギーの傾向
上の画像は、最初のイオン化エネルギーが期間を通じてどのように変化するかを示しています。希ガスは、完全に満たされた電子殻で構成された原子を持っているため、最初のイオン化エネルギーが最も高くなります。したがって、これらの原子は非常に安定しています。この安定性のために、最も外側の電子を除去することは非常に困難です。
二次イオン化エネルギーとは
第 2 イオン化エネルギーは、ガス状の正に帯電した原子から最も外側の電子を取り除くのに必要なエネルギー量として定義できます。中性に帯電した原子から電子を取り除くと、正の電荷が生じます。これは、原子核の正電荷を中和するのに十分な電子がないためです。このプラスに帯電した原子から別の電子を取り除くには、非常に高いエネルギーが必要です。この量のエネルギーは、第 2 イオン化エネルギーと呼ばれます。これは、以下のような反応で与えられます。
X(g) → X(g) + へ
2 番目のイオン化エネルギーは常に 1 番目のイオン化エネルギーよりも高い値になります。これは、中性に帯電した原子よりも正に帯電した原子から電子を除去することが非常に難しいためです。
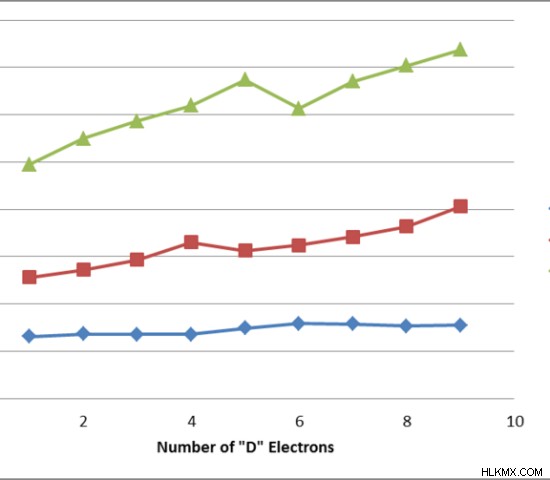
図 2:遷移金属の第 1、第 2、第 3 イオン化エネルギーの違い
上の画像は、1 番目、2 番目、3 番目のイオン化エネルギーの違いを示しています。この違いは、プラスの電荷が増えると電子を引き抜きにくくなるためです。さらに、電子が取り除かれると、原子半径は減少します。また、別の電子を除去することも困難になります。
第 1 イオン化エネルギーと第 2 イオン化エネルギーの違い
定義
第一イオン化エネルギー: 最初のイオン化エネルギーは、ガス状の中性原子が最も外側の電子を除去するために必要なエネルギー量です。
第 2 イオン化エネルギー: 第二イオン化エネルギーは、ガス状の正に帯電した原子が最も外側の電子を除去するために必要なエネルギー量です。
値
第一イオン化エネルギー: 第一イオン化エネルギーは比較的低い値です。
第 2 イオン化エネルギー: 第二イオン化エネルギーは比較的高い値です。
開始種
第一イオン化エネルギー: 最初のイオン化エネルギーは、中性荷電原子に関して定義されます。
第 2 イオン化エネルギー: 2 番目のイオン化エネルギーは、正に帯電した原子に関して定義されます。
最終製品
第一イオン化エネルギー: 最終生成物は、最初のイオン化後の +1 荷電原子です。
第 2 イオン化エネルギー: 最終生成物は、2 回目のイオン化後の +2 荷電原子です。
結論
イオン化エネルギー値は、化学元素の反応性を決定する上で重要です。また、化学反応が起こるかどうかを判断するのにも役立ちます。イオン化エネルギーは、ある反応の活性化エネルギーとして働くことがあります。第 1 イオン化エネルギーと第 2 イオン化エネルギーの主な違いは、特定の元素について、第 1 イオン化エネルギーが第 2 イオン化エネルギーよりも低い値であることです。