主な違い – アボガドロ定数とアボガドロ数
用語、ほくろ 、アボガドロ数 そしてアボガドロ定数 互いに関連しています。モルは、物質の量を測定するために使用される単位です。あらゆる化学物質の測定に使用できます。 1モルの値は6.022×10です。これをアボガドロ数と呼びます。アボガドロ数は、物質1モル中に存在する粒子の数です。任意の物質のモルは、この粒子の数に等しくなります。これらの粒子は、原子、分子、コロイド、または何でもかまいません。したがって、対象となる物質の種類に依存しない定数となり、アボガドロ定数と呼ばれます。アボガドロ数とアボガドロ定数の主な違いは、アボガドロ数は単位のない数値として与えられるのに対し、アボガドロ定数は 1 モルあたりの単位 (mol) で与えられることです。
対象となる主な分野
1. アボガドロ定数とは
– 定義、歴史的背景、単位、用途
2. アボガドロ数とは
– 定義、歴史的背景、アプリケーション
3. アボガドロ定数とアボガドロ数の関係
– アボガドロ定数とアボガドロ数
4. アボガドロ定数とアボガドロ数の違い
– 主な違いの比較
重要な用語:アボガドロ、アボガドロ定数、アボガドロ数、モル 
アボガドロ定数とは
アボガドロ定数は、物質 1 モル中に存在する粒子の数です。これは、科学者アメデオ・アボガドロにちなんで名付けられました。このアボガドロ定数は、科学者が微視的な物質の量を巨視的な物質の量に関連付けたいと考えたために発明されました。たとえば、特定の化学反応では、使用される物質の量は、その物質に存在する原子または分子の数に関連している必要があります。そうして初めて、その反応によって得られる生成物の量を特定して予測することができます。
この定数の値は、ドイツの科学者ジャン=バティスト・ペランによって最初に計算されました。アボガドロ定数に与えられた値は 6.022 x 10 でした。この数値には「モル」という名前が付けられました。物質の 1 モルは、6.022 x 10 個の粒子で構成されています。たとえば、1 モルのナトリウムは 6.022 x 10 個のナトリウム原子で構成されています。塩化ナトリウム 1 モルは、6.022 x 10 の塩化ナトリウム分子で構成されています。したがって、アボガドロ定数の単位は mol です。 1 モルのアボガドロ定数は 6.022 x 10mol です。
アボガドロ定数は、特定の化学反応で反応する物質の量を決定するのに役立ちます。また、その反応によって得られる生成物の量を決定するのにも役立ちます。さらに、その反応が起こるかどうかも予測できます。アボガドロ定数は、原子質量、分子質量、およびその他の関連する概念を決定する際に使用されます。 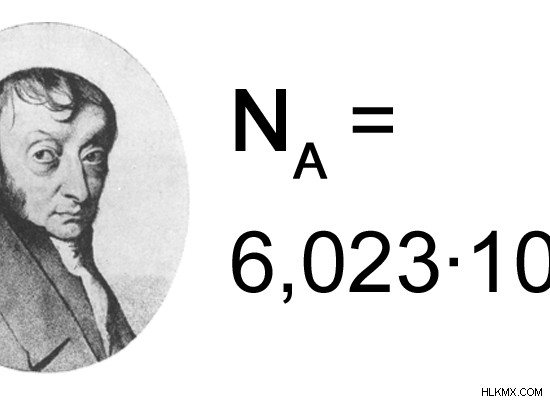
アボガドロ数とは
アボガドロ数は 6.022 x 10 です。これはアボガドロ定数に与えられた値です。アボガドロ数で表される同じものは、ドイツの科学者ヨハン・ロシュミットによって最初に計算されましたが、異なる単位で計算されました.しかし、実際のアボガドロ数は、この値に名前を付けた科学者ジャン=バティスト・ペランによって計算されましたアボガドロ数 モグラについての概念を最初に与えたアボガドロに敬意を表して。その後、アボガドロ数に関する概念は、科学技術の発展とともに急速に発展しました。
物質の 1 モルは、アボガドロ数の粒子で構成されています。これらの粒子は、原子、イオン、分子、コロイドなどです。考慮される粒子は、考慮される物質の性質によって異なります。アボガドロ数は、化学元素の 1 モルに存在する原子の数、または特定の化合物に存在する分子の数を示すため、この用語は原子質量と分子質量を決定するのに役立ちます。
アボガドロ定数とアボガドロ数の関係
- アボガドロ数は、アボガドロ定数の値です。
アボガドロ定数とアボガドロ数の違い
定義
アボガドロ定数: アボガドロ定数は、物質 1 モル中に存在する粒子の数です。
アボガドロ数: アボガドロ数は 6.022 x 10 です。
その他の定義
アボガドロ定数: アボガドロ定数は、特定の化合物 1 モル中に存在する基本単位の数は、どの化合物についても一定の値であると述べています。
アボガドロ数: アボガドロ数は、1 グラムの H に存在する水素原子の数、または 1 グラムの C サンプルに存在する炭素原子の数です。
ユニット
アボガドロ定数: アボガドロ定数の単位は mol (1 モルあたり) です。
アボガドロ数: アボガドロ数には単位がありません。
結論
アボガドロ数とアボガドロ定数は同じ概念を表しています。これらの概念は両方とも、特定の物質の 1 モルに存在する粒子の数を表します。それらは同じ値を持っています。ただし、ユニットによって異なります。アボガドロ数とアボガドロ定数の主な違いは、アボガドロ数が単位のない数として与えられるのに対し、アボガドロ定数はモル当たり (mol) の単位で与えられることです。