主な違い – リアルガスと理想ガス
気体は、物質が存在できる物理的状態の一種です。化合物の粒子または分子が容器内のどこにでも自由に移動できる場合、この化合物はガス。気体の状態は、粒子または分子の詰め方によって、他の 2 つの物理的状態 (固体および液体の状態) とは異なります。実在気体は、実際に存在する気体化合物です。理想気体は、現実には存在しない気体化合物ですが、仮想気体です。ただし、一部の気体化合物は、特定の温度および圧力条件で理想気体とほぼ同様の挙動を示します。したがって、理想気体であると仮定することで、その種の実在気体に気体法則を適用できます。適切な条件が整っていても、実在気体と理想気体の違いにより、実在気体は理想気体の挙動に 100% 近づくことはできません。実在気体と理想気体の主な違いは、実在気体分子には分子間力があるのに対し、理想気体には分子間力がないことです。
対象となる主な分野
1.実在気体とは
– 定義、特定のプロパティ
2. 理想気体とは
– 定義、特定のプロパティ
3.実在気体と理想気体の違いは何ですか
– 主な違いの比較
重要な用語:気体、理想気体、気体の法則、分子間力、実在気体

実在ガスとは
実在気体は、環境に実際に存在する気体化合物です。これらの実在気体は、粒子と呼ばれるさまざまな原子または分子で構成されています。これらのガス粒子は常に動いています。気体の粒子には一定の体積と質量があります。したがって、気体には一定の体積と質量があります。ガスの体積は、ガスが入っている容器の体積と見なされます。
一部の実在気体は原子で構成されています。たとえば、ヘリウムガスはヘリウム原子で構成されています。しかし、他のガスは分子で構成されています。たとえば、窒素ガスは N2 で構成されています 分子。したがって、これらのガスには質量と体積があります。
さらに、実在する気体分子には分子間引力があります。これらの引力は、ファン デル ワールス相互作用と呼ばれます。これらの引力は弱いです。実在気体分子間の衝突は非弾性です。これは、2 つの実在するガス粒子が互いに衝突すると、粒子のエネルギーの変化とその移動方向の変化が観測できることを意味します。
ただし、一部の実在気体は、低圧および高温条件下で理想気体として振る舞う場合があります。高温では、ガス分子の運動エネルギーが増加します。そのため、気体分子の動きが速くなります。これにより、実際のガス分子間の分子間相互作用が少なくなるか、まったくなくなります。
したがって、低圧および高温の条件では、実在気体に気体法則を適用できます。たとえば、低圧と高温で;
PV / nRT ≈ 1
ここで、P はガスの圧力です。
V はガスの体積、
n はガスのモル数、
R は理想気体定数で、
T はシステムの温度です。
この値は、圧縮係数と呼ばれます .理想気体からの実在気体の性質のずれの補正係数として用いられる値です。しかし、実在気体の場合、PV ≠ nRT.
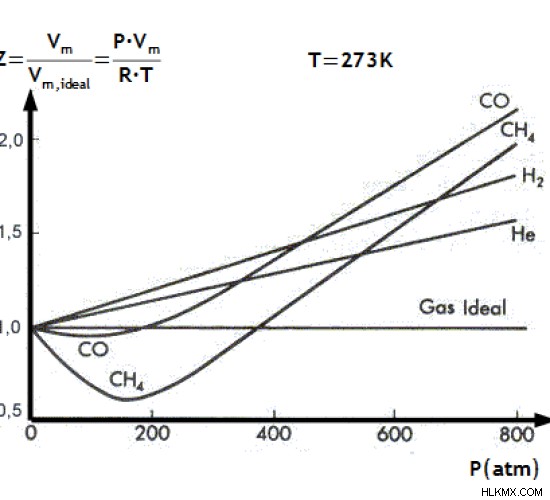
図 1:理想気体の圧縮率に対するさまざまな気体の圧縮率
PV /nRT の値は正確に 1 に等しくはありませんが、低圧と高温の条件ではほぼ同じ値です。
理想気体とは
理想気体は、環境に実際には存在しない架空の気体です。実在気体の挙動は複雑で互いに異なるため、理想気体の概念が導入されました。実在気体の挙動は、理想気体の特性に関して記述できます。
理想気体は、ごくわずかな体積と質量を持つ非常に小さな分子で構成される気体化合物です。私たちがすでに知っているように、すべての実在する気体は、一定の体積と質量を持つ原子または分子で構成されています。理想気体分子間の衝突は弾性的です。これは、ガス粒子の運動エネルギーまたは移動方向に変化がないことを意味します。
理想気体粒子間に引力はありません。したがって、粒子はあちこち自由に動きます。ただし、理想気体は、分子間力の形成をもたらす減少した運動エネルギーで気体粒子が互いに接近するため、高圧および低温で実際の気体になる可能性があります。
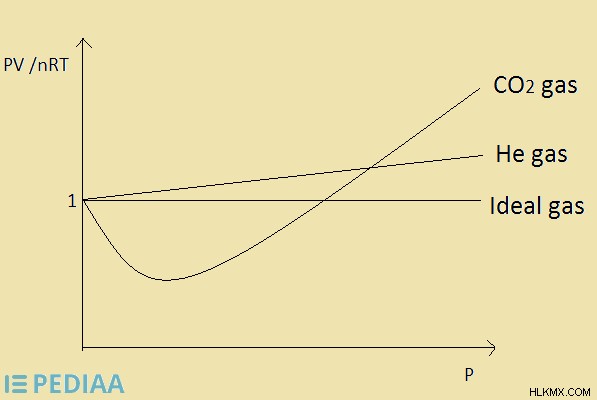
図 2:He ガスと CO2 ガスに対する理想ガスの挙動
理想気体は、仮定なしですべての気体法則に従います。理想気体の PV /nRT の値は 1 です。したがって、PV の値は nRT の値と等しくなります。この値 (圧縮係数) が特定の気体で 1 に等しい場合、その気体は理想気体です。
実在気体と理想気体の違い
定義
本物のガス : 実際の気体は、環境に実際に存在する気体化合物です。
理想ガス : 理想気体は、環境に実際には存在しない架空の気体です。
分子間引力
本物のガス : 実在するガス粒子間には分子間引力があります。
理想ガス : 理想気体粒子間に分子間引力はありません。
ガス粒子
本物のガス : 実在気体の粒子には、一定の体積と質量があります。
理想ガス : 理想気体の粒子には、一定の体積と質量がありません。
衝突
本物のガス : 実在気体分子間の衝突は非弾性です。
理想ガス : 理想気体分子間の衝突は弾性的です。
運動エネルギー
本物のガス : 実際のガス粒子の運動エネルギーは、衝突によって変化します。
理想ガス : 理想気体粒子の運動エネルギーは一定です。
州の変化
本物のガス : 実在気体は、低圧で高温の条件では理想気体のように振る舞う場合があります。
理想ガス : 理想気体は、高圧および低温条件で実在気体のように振る舞う場合があります。
結論
実在気体は、環境に実際に存在する気体化合物です。しかし、理想気体は実際には存在しない仮想気体です。これらの理想気体は、実在気体の挙動を理解するために使用できます。実在気体に気体法則を適用する場合、実在気体は低圧および高温の条件で理想気体として振る舞うと仮定できます。しかし、正確な方法は、仮定するのではなく、計算に補正係数を使用することです。補正係数は、実際のガスと理想的なガスの差を決定することによって得られます。