主な違い – 原子番号と質量数
原子は、電子、陽子、および中性子で構成されています。陽子と中性子が一緒になって原子核を作ります。原子の質量を測定するとき、実際には原子核の質量を測定します。これは、陽子や中性子と比較すると、電子の質量が無視できるためです。原子番号と原子の質量数は、原子に存在する陽子の数と中性子の数に関する詳細を提供するため、2 つの重要な用語です。 主な違い 原子番号と質量番号の間には、原子番号は原子に存在する陽子の数を示し、質量数は原子に存在する陽子の数と中性子の数の合計を示します。
対象となる主な分野
1.原子番号とは
– 定義、例による説明
2.質量数とは
– 定義、例による説明
3.原子番号と質量数の違いは何ですか
– 主な違いの比較
重要な用語:原子、原子番号、電子、同位体、質量数、中性子、原子核、陽子

原子番号とは
原子番号は、原子に存在する陽子の数です。陽子は原子核の中にあります。原子中の陽子の数は、化学元素の固有の特性です。したがって、原子に存在する陽子の数を見つけることで、特定の化学元素を特定できます。すべての原子には、少なくとも 1 つの陽子があります。たとえば、水素原子には陽子が 1 つしかありません。
原子番号は陽子の数なので、原子番号に単位はありません。たとえば、ヘリウムの陽子の数は 2 です。したがって、ヘリウムの原子番号は 2 です。通常、原子番号は特定の方法で化学元素の記号とともに与えられます。以下に例を示します。

図 1:原子番号は化学記号の前に小文字で表示されます。
同位体は、陽子の数は同じで中性子の数が異なる原子です。これらの同位体には同じ数の陽子があるため、同じ化学元素に属します。したがって、同位体について話しているときは、同じ元素のさまざまな形態について話していることになります.
陽子は正に帯電した亜原子粒子です。したがって、原子番号は原子核の全正電荷を示します。中性原子では、陽子の数は電子の数と同じです。なぜなら、中性であるためには、すべての正電荷が電子の負電荷から中和されなければならないからです。したがって、原子番号は中性原子に存在する電子の数と同じです。
元素が放射性である場合、元素の原子番号を変更できます。これは、一部の元素が放射能を受けると、陽子が別の亜原子粒子に変換されるか、中性子が陽子に変換される可能性があるためです。いずれにせよ、原子に存在する陽子の数が変わります。これは別の元素に変化します (原子番号の変化は元素を変化させます)。
質量数とは
質量数は、原子の陽子と中性子の数の合計です。これは、質量数が原子核に存在する素粒子の総数であることを意味します。陽子または中性子だけを核子と呼びます。したがって、質量数は、原子核に存在する核子の総数としても与えられます。
これは、原子の質量を決定するため、質量数と呼ばれます。原子の質量は、その原子の陽子と中性子の合計質量です。これは、陽子や中性子と比較すると、電子の質量が無視できるためです。
安定した原子では陽子の数と中性子の数が等しいため、原子の質量数は原子番号の約 2 倍になります。ただし、同位体では、質量数が原子番号の 2 倍に等しい場合とそうでない場合があります。これは、同位体の陽子の数は同じですが、中性子の数が異なるためです。そのため、それらの質量数は期待値とは異なります。
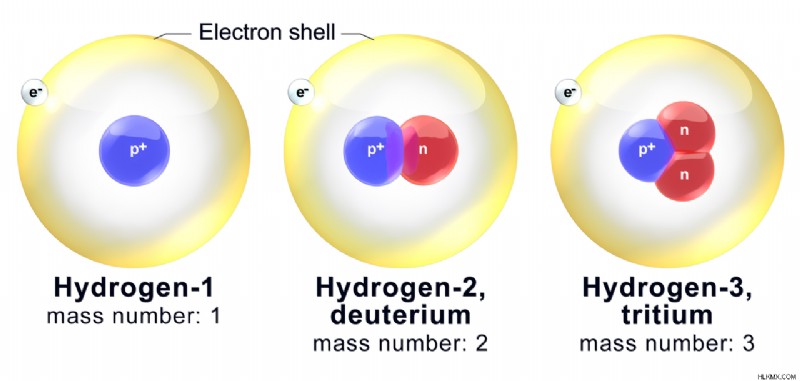
図 2:水素の主要な同位体とその質量数
それとは別に、等圧線と呼ばれる物質がいくつかあります。これらは、同じ質量数を持つ異なる元素の原子ですが、原子番号が異なります。たとえば、塩素 37 とアルゴン 37 の質量数は同じです。したがって、それらは等圧線です。
原子は、放射性原子核から 2 つの陽子と 2 つの中性子を除去するアルファ崩壊を受けることが多いため、元素の質量数はそれに応じて変化する可能性があります。次に、質量数が 4 単位変更されます。
原子番号と質量数の違い
定義
原子番号: 原子番号は、原子に存在する陽子の数です。
質量数: 質量数は、原子の陽子と中性子の数の合計です。
中性子の数
原子番号: 中性子の数は、原子の原子番号には影響しません。
質量数: 中性子の数は原子の質量に影響しません。
同位体
原子番号: 同位体は同じ原子番号を持っています。
質量数: 同位体には異なる質量数があります。
等圧線
原子番号: アイソバーは同じ原子番号を持つことはできません.
質量数: 等圧線は同じ質量数です。
値
原子番号: 原子番号は常に質量数よりも小さい値です.
質量数: 質量数は常に原子番号よりも大きな値です.
結論
原子番号と質量数は、原子に関する基本的な詳細です。原子番号は、特定の化学元素の一意の値です。しかし、同じ質量数を持つ元素が存在する可能性があります。それらは等圧線と呼ばれます。また、原子番号が同じで質量数が異なる原子であっても、同じ元素に属する原子が存在することがあります。それらは同位体と呼ばれます。原子番号と質量数の主な違いは、原子番号は原子に存在する陽子の数を示すのに対し、質量数は原子に存在する陽子の数と中性子の数の合計を示すことです.







