主な違い - アルカリとアルカリ
アルカリ金属とアルカリ土類金属は基本元素であり、それらが形成する化合物も基本化合物です。水に加えると、溶液は pH 7 よりも高い pH 値を示します。これらの化合物は、媒体の酸性度を中和または低下させるなど、さまざまな目的で使用されます。アルカリ金属は周期表のグループ 1 の金属ですが、アルカリ土類金属はグループ 2 にあります。アルカリとアルカリの主な違いは、アルカリ金属には 1 つの価電子があるのに対し、アルカリ土類金属には 2 つの価電子があることです。
対象となる主な分野
1.アルカリとは
– 定義、プロパティ、例
2.アルカリ性とは
– 定義、プロパティ、例
3.アルカリとアルカリの類似点は何ですか
– 共通機能の概要
4.アルカリとアルカリの違いは何ですか
–主な違いの比較
キーワード:アルカリ、アルカリ金属、アルカリ、アルカリ土類金属、周期表、pH、価電子
アルカリとは
アルカリという用語は、周期表の第 1 族の元素 (リチウム、ナトリウム、カリウムなど) に名前を付けるために使用されます。これらの元素はアルカリ金属として知られています。これらの元素から形成される塩基性化合物がアルカリ化合物です。アルカリ化合物は、水に加えるとOHイオンを形成できる物質です。したがって、アルカリ化合物は水に溶解し、pH 7 よりも高い値の溶液になります。すべてのアルカリの pH 値は 7 よりも大きくなります。これらは塩基性化合物です。
アルカリ物質は、赤色リトマスの色を青色に変えることができます。また、最終生成物として塩と水を与える酸性化合物と反応することもあります。したがって、アルカリ物質を使用して酸性溶液を中和することができます。アルカリ金属はとても柔らかいです(ナトリウムはナイフで簡単に切ることができます)。これらの元素は、最も外側の軌道に 1 つの価電子を持っています。したがって、それらは非常に反応的な要素です。価電子を除去することにより、+1 カチオンを形成できます。
アルカリの濃縮形態では、腐食性があり、皮膚の炎症を引き起こす可能性があります.最も一般的なアルカリには、水酸化物と炭酸塩が含まれます。酸と水酸化物との反応により、塩と水が得られます。酸と炭酸塩が反応すると、塩、水、二酸化炭素ガスが生成されます。

図 1:水酸化ナトリウム
例
- 水酸化ナトリウム (NaOH)
- 水酸化カリウム (KOH)
- 酸化リチウム (Li2 O)
- アンモニア (NH3 )
アルカリ性とは
アルカリという用語は、周期表の第 2 族元素 (マグネシウム、カルシウム、ストロンチウムなど) の名前として使用されます。これらはアルカリ土類金属として知られています。これらの化合物は、水に加えると OH イオンも形成します。アルカリ性化合物の溶液は、より高い pH 値 (>7) を持っています。
これらのアルカリ性化合物は、赤色のリトマスを青色に変えることもできます.それらには基本的なプロパティがあります。アルカリ土類金属はアルカリ金属よりも硬いです。これらの元素は 2 つの価電子を持っているため、+2 カチオンを形成し、これらの電子を除去することでカチオンを形成できます。ただし、これらの電子は電子対として s 軌道にあるため、これらの元素はそれほど反応しません。
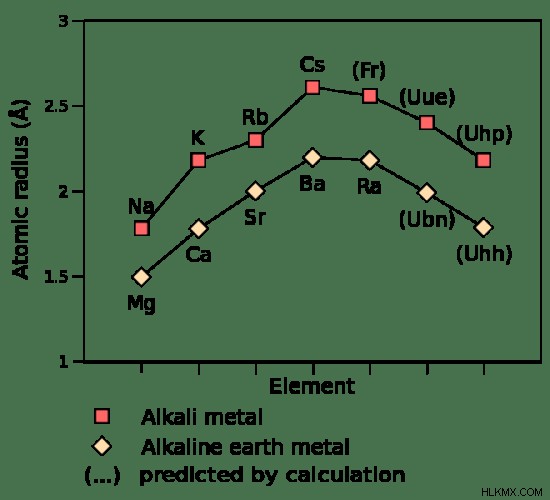
図 2:アルカリ金属とアルカリ土類金属の原子半径の比較
アルカリ土類金属は、アルカリ金属より原子半径が小さいです。これは、電子と陽子の数が隣接する第 1 族元素よりも多いためです。
アルカリとアルカリの類似点
- どちらにも基本的な特性があります。
- どちらも赤色リトマスを青色に変えることができます。
- どちらのタイプの化合物も、pH 7 を超える水溶液を形成できます。
- どちらも、水に加えると OH イオンを形成できます。
アルカリとアルカリの違い
定義
アルカリ :アルカリという用語は、周期表の第 1 族の元素に名前を付けるために使用されます。
アルカリ性: アルカリという用語は、周期表の第 2 族元素の名前に使用されます。
物理的特性
アルカリ :アルカリ金属は柔らかい。
アルカリ性: アルカリ土類金属は硬いです。
価電子
アルカリ :アルカリ元素は 1 つの価電子を持っています。
アルカリ性: アルカリ土類金属には 2 つの価電子があります。
陽イオン
アルカリ :アルカリ金属は+1カチオンを形成します。
アルカリ性: アルカリ土類金属は +2 陽イオンを形成します。
イオン化エネルギー
アルカリ :アルカリ金属はイオン化エネルギーが低くなります。
アルカリ性: アルカリ土類金属は、より高いイオン化エネルギーを持っています.
結論
アルカリ金属は、周期表の第 1 族の元素です。アルカリ土類金属は 2 族の元素です。どちらも基本的な性質を持っています。水に加えると、どちらもより高い pH 値 (>pH) を持つ溶液を形成できます。アルカリとアルカリの主な違いは、アルカリ金属には1つの価電子があるのに対し、アルカリ土類金属には2つの価電子があることです。