主な違い – 相対原子質量と原子質量
原子は物質の基本単位です。科学的発見により、原子はさらに亜原子粒子 (電子、陽子、中性子) に分割できることが明らかになりました。また、原子は原子核と呼ばれる中心核と、この原子核の周りを電子が動き回る複雑な構造を持っていることも発見されました。原子核には陽子と中性子が含まれています。相対原子質量と原子質量は、原子の質量を表すために使用される 2 つの化学用語です。相対原子質量と原子質量の主な違いは、相対原子質量は元素の原子の平均質量と炭素-12の質量の12分の1の比率であるのに対し、原子質量は存在する核子の総質量であることです。原子核内。
対象となる主な分野
1.相対原子質量とは
– 定義、計算、例
2.原子量とは
– 定義、計算、例
3.相対原子質量と原子質量の違いは何ですか
– 主な違いの比較
重要な用語:原子、原子質量、電子、中性子、原子核、陽子、相対原子質量

相対原子質量とは
相対原子質量は、炭素 12 の質量の 12 分の 1 に対する元素の平均原子質量の比率です。炭素 12 の原子の質量の 12 分の 1 は、原子質量単位 (1 amu または 1 u) と呼ばれます。したがって、炭素 12 の相対原子質量は 12 amu です。
相対原子質量 =原子の平均質量/炭素の質量-12 x (1/12)
原子の平均質量は、元素のさまざまな同位体の質量とその存在量を使用して計算されます。炭素 12 同位体の質量の 12 分の 1 の値は、1.66054 x 10g です。これは、1 u または 1 つの統一原子質量単位に相当します。水素原子を考えて、相対原子質量を計算してみましょう。
水素の相対原子質量
まず、水素原子の平均質量を見つける必要があります。
| 同位体 | 存在量 (%) | 質量 (u) |
| 水素-1 | 99.98 | 1.007825 |
| 水素-2 | 0.02 | 2.014101 |
| 水素-3 | トレース | 3.016049 |
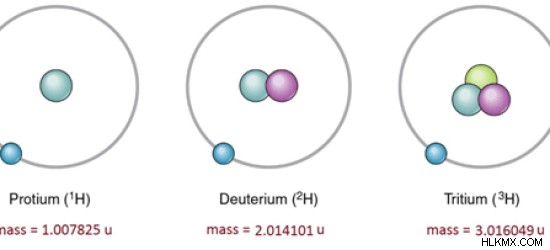
図 1:水素の同位体
水素の平均質量=(1.007825 u x 99.98%) +(2.014101 U x0.02%)
=(1.007623 + 0.0000402)u
=1.0076632 u
炭素 12 同位体の質量の 12 分の 1 の値は 1 u です。
したがって、
相対原子質量 =原子の平均質量/炭素 12 の質量 x (1/12)
=1.0076632 u / 1 u
0 2. 6
ここでは、トリチウムの存在量は環境に微量であり無視できるため、計算にトリチウムの質量は含まれていません。相対値であるため、最終値は無次元です。
原子質量とは
原子質量は、原子核に存在する核子の総質量です。核子は、陽子または中性子のいずれかです。したがって、原子質量は、原子核に存在する陽子と中性子の合計質量です。電子は原子にも存在しますが、陽子や中性子に比べて電子は非常に小さく、無視できる質量であるため、電子の質量は計算に使用されません。
相対原子質量とは異なり、ここでは平均値を計算せずにすべての原子の質量を計算します。したがって、異なる同位体の原子質量に対して異なる値が得られます。これは、同じ元素の同位体に存在する核子の数が互いに異なるためです.
相対原子質量と同じ例を考えてみましょう。水素。
水素 2 の原子質量
水素 2 (重水素) 同位体の原子量は次のように計算されます。
原子核の陽子の数 =1
原子核の中の中性子の数 =1
水素の原子質量 =(1 amu +1 amu)
=2 amu
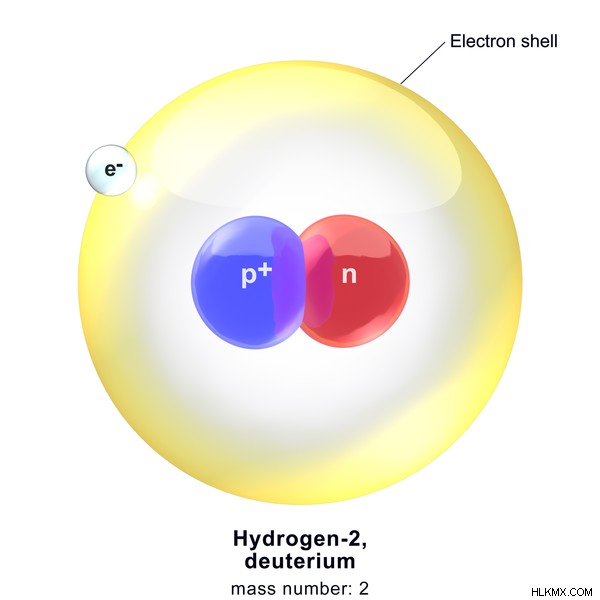
図 2:重水素の構造
原子質量は単位 amu (原子質量単位) で与えられます。 1 個の陽子または中性子の質量は 1 amu です。
相対原子質量と原子質量の違い
定義
相対原子質量: 相対原子質量は、元素の原子の平均質量と炭素 12 の質量の 12 分の 1 との比率です。
原子質量: 原子質量は、原子核に存在する核子の総質量です。
同位体
相対原子質量: 相対原子質量は、元素のすべての同位体の質量と存在割合を使用して計算されます。
原子質量: 原子質量は、核子の質量を加算することにより、すべての同位体ごとに個別に計算されます。
値
相対原子質量: 相対原子質量の値は、炭素 12 原子の質量の 12 分の 1 を基準にして得られます。
原子質量: 原子質量の値は直接計算された値です (相対値ではありません)。
ユニット
相対原子質量: 相対原子量は相対値であるため、無次元です。
原子質量: 原子質量は単位 amu で与えられます。
結論
原子質量と相対原子質量は、2 つの重要な化学用語です。似ているように聞こえますが、概念は異なります。相対原子質量と原子質量の主な違いは、相対原子質量は元素の原子の平均質量と炭素12の質量の12分の1の比率であるのに対し、原子質量は核内に存在する核子の総質量であることです。







