主な違い – 元素 vs 分子 vs 化合物
要素、分子、および化合物という用語は、この記事で後述するように、異なる定義と特性を持っています。多くの場合、化合物という用語を使用して分子に名前を付けますが、すべての化合物が分子だけであるとは限りません。化合物と呼べる化学種は他にもたくさんあります。元素とは、化学的手段によってそれ以上分解できない物質です。分子は、化学結合を介して結合された 2 つ以上の原子から構成される物質です。化合物は、化学結合を介して結合されたさまざまな種類の原子で構成される分子です。したがって、化合物も分子の一種ですが、同じではありません。元素、分子、化合物の主な違いは、元素は化学的手段によってさらに部分に分割できない物質であるのに対し、分子は化学的手段によってさらに部分に分割できる物質であり、化合物も分子の一種ですが、異なるタイプの分子で構成されています。
対象となる主な分野
1.要素とは
– 定義、周期表、反応性、同位体
2.分子とは
– 定義、化学式、さまざまなタイプ
3.化合物とは
– 定義、さまざまなタイプ
4.元素分子と化合物の関係とは
5.元素分子と化合物の違いは何ですか
– 主な相違点の比較
重要な用語:原子、原子番号、元素、化学結合、化合物、共有結合、電子配置、イオン結合、質量数、分子

要素とは
化学元素は、化学的手段では分解できない物質です。これまでに、さまざまな元素が発見されています。それらは、核内の陽子の数という固有の特性を持っています。これを原子番号といいます。元素の原子番号は、特定の元素の固定値です。 2 つの元素が同じ原子番号を持つことはできません。原子番号が変わると、元素が変わります。ただし、元素は核反応によって変化する可能性があります。
周期表
化学元素は、原子番号と電子配置に基づいて元素の周期表に配置されます。化学元素は、原子の種または原子のグループとして説明することもできます。これは、どこにでもある原子が特定の化学元素に属しているためです。これは、特定の化学元素の原子番号が一意であるためです。
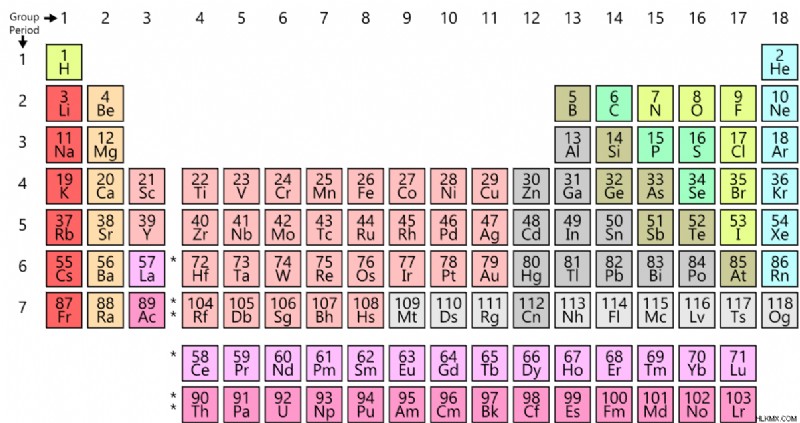
図 1:元素の周期表
元素の周期表には、化学元素のさまざまなカテゴリがあります。分類の一部を以下に示します。
- 金属、非金属、半金属
- s ブロック要素、p ブロック要素、d ブロック要素、f ブロック要素
- アルカリ金属、アルカリ土類金属、遷移金属
- ハロゲン、希ガスなど
反応性
一部の化学元素は不活性です。反応性が低いものもあれば、非常に反応性が高いものもあります。不活性化学元素には、希ガスのグループが含まれます。他のすべての元素は、化学反応を容易に起こすことができます。これは、希ガスの電子配置による不完全な電子殻がなく、個々の原子として非常に安定しているためです。他の要素と反応する理由はありません。しかし、他の化学元素の電子配置は不完全です。したがって、それらは電子殻を満たすために異なる化学反応を受けます。反応性の低い化学元素は、部分的に満たされていますが、安定した電子配置を持っています。

図 2:金属活動シリーズ
同位体
一部の化学元素は非常に不安定であるため、放射性が高くなります。安定した状態になるまで、時間の経過とともに減衰します。一部の化学元素には、同位体として知られるさまざまな形態があります。特定の化学元素の同位体は、原子番号は同じですが質量数が異なります。これは、核内の陽子の数が同じであることを意味します。したがって、それらは同じ化学元素に属します。しかし、原子核の中の中性子の数は互いに異なります。
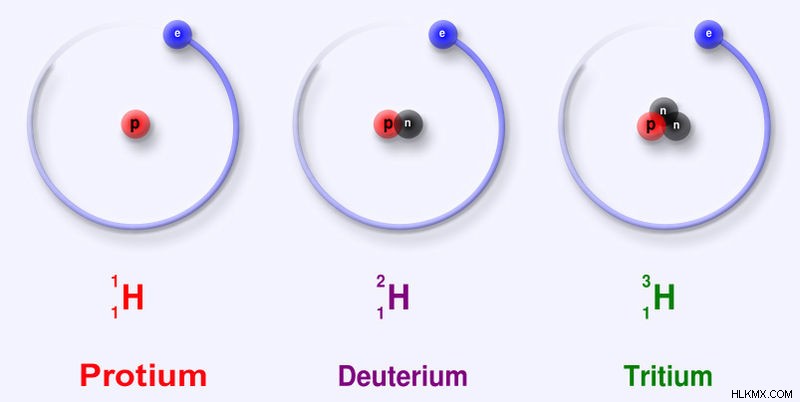
図 3:水素化学元素の同位体
すべての要素に名前を付けるために使用される名前と記号があります。これらの名前のほとんどはラテン語であり、記号はそれに応じて派生しています。
分子とは
分子は、互いに化学的に結合した 2 つ以上の原子のグループであり、中性です。分子には、同じ化学元素または異なる化学元素の原子が含まれる場合があります。化学における分子は、中性の電荷を持つ多原子化学種です。分子は、分子の化学的および物理的特性に応じて、さまざまなグループに分類できます。
分子には、共有結合またはイオン結合のいずれかを介して結合した原子が含まれる場合があります。共有結合は、2 つの原子が不対電子を共有するときに形成されます。イオン結合は、2 つ以上の原子間の静電引力です。
化学式
分子内の原子の組成は、その化学式によって与えられます。実験式は、原子間の比率を示します。たとえば、C3 H6 プロペンの化学式です。 3 つの炭素原子と 6 つの水素原子が互いに結合しています。この分子の実験式は CH2 です。 .
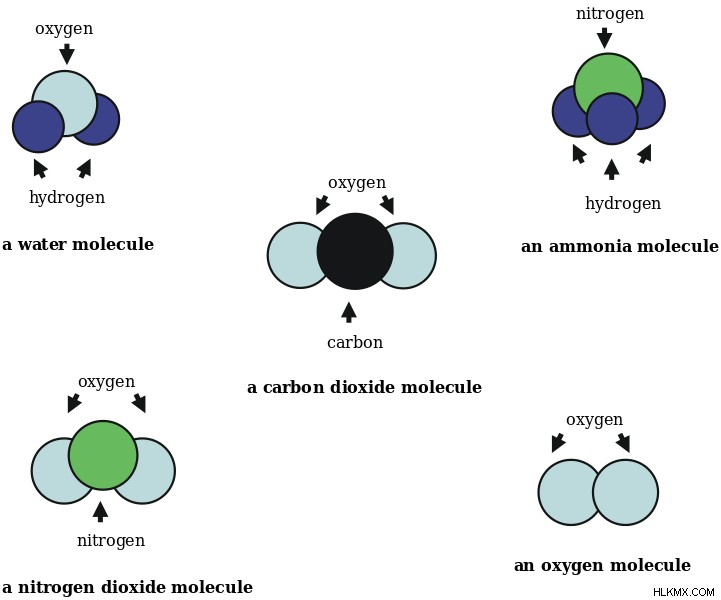
図 4:いくつかの一般的な分子
さまざまな種類の分子
- 分子内に存在する原子の種類に基づいて、同核または異核のいずれかになります。 同核分子 同じ元素の原子で構成されています。 異核分子 さまざまな化学元素の原子で構成されています。
- 分子は有機または無機のいずれかです。 有機分子 基本的にC、Hと他の元素で構成されています。 無機分子 さまざまな化学元素のさまざまな組み合わせが含まれている可能性があります。
- 分子あたりの原子数:二原子 分子、三原子 分子、多原子分子 .
- 共有結合のみで構成される分子は共有分子です 、イオン結合を含む分子はイオン分子です .
- 幾何学によると、分子は対称または非対称分子のいずれかになります .たとえば、CO2 の線形ジオメトリ 対称分子にします。
同様に、自然界には多くの種類の分子が存在します。それらにはさまざまな豊富さがあります。個々の原子は分子ではありません。たとえば、ヘリウム (He) は分子ではありません。
化合物とは
化合物は、2 つ以上の原子が共有結合またはイオン結合で化学的に結合して形成される化学種です。すべての化合物は分子ですが、すべての分子が化合物であるとは限りません。等核分子は化合物ではありません。異核分子のみが化合物と見なされます。化合物はさまざまな方法でグループ化できますが、以下に挙げるのはほんの一部です。

図 5:これは、さまざまな化学元素の原子を含む共有結合化合物です
さまざまな種類の化合物
- 原子の数に基づいて、化合物は二原子、三原子、または多原子になります。
- 化学結合の種類に基づいて、共有化合物 共有結合とイオン性化合物を含む イオン結合を含む
- 複雑さに基づいて、一部の化合物は単純な化合物です その他は複雑な化合物です .
- 成分 (陽イオン、陰イオン) に基づいて、化合物は有機化合物または無機化合物になります。有機化合物 炭化水素、カルボン酸、アミド、アンミン、アルコールなどが含まれます。 無機化合物 酸化物、水素化物、ハロゲン化物、亜硝酸塩、硝酸塩、炭酸塩など
元素分子と化合物の関係
- 分子は、同じまたは異なる化学元素の原子から作られています。さまざまな種類の元素を含む分子は化合物と呼ばれます。
元素分子と化合物の違い
定義
要素: 化学元素とは、化学的手段では分解できない物質です。
分子: 分子は、互いに化学的に結合した 2 つ以上の原子のグループです。
複合: 化合物は、2 つ以上の原子が共有結合またはイオン結合で化学的に結合したときに形成される化学種です。
メンバー
要素: 115 の既知の化学元素があります。
分子: 互いに化学結合した 2 つ以上の原子から構成される物質は分子です。
複合: 異なる化学元素の 2 つ以上の原子から構成される物質は化合物です。
独自のプロパティ
要素: 化学元素には固有の原子番号が含まれています。
分子: 分子は等核または異核のいずれかです。
複合: 異核分子は化合物です。
化学元素
要素: 要素に類似のアトムが含まれています。
分子: 分子は、同じ元素または異なる元素の原子を持つことができます。
複合: 化合物には、さまざまな元素の原子があります。
化学結合
要素: さまざまな元素の原子は、電子配置と安定性に応じて、さまざまな種類の化学結合を形成できます。
分子: 分子は、共有結合またはイオン結合のいずれかを持つことができます。
複合: 化合物は、共有結合、イオン結合、または金属結合を持つことができます。
例
要素: 化学元素の例には、酸素、水素、窒素、銅、亜鉛などがあります。
分子: 分子の例としては、酸素 (O2 )、オゾン (O3 )、水 (H2 O)など
複合: 化合物の例としては、塩化ナトリウム (NaCl)、炭酸カルシウム (CaCO
結論
分子は化学元素で構成されています。 2 つ以上の異なる化学元素を含む分子は、化合物として知られています。元素分子と化合物の主な違いは、元素は化学的手段によってさらに部分に分割できない物質であるのに対し、分子は化学的手段によってさらに部分に分割できる物質であり、化合物も分子の一種であるということですしかし、さまざまな種類の分子で構成されています。