主な違い – アンモニアとアンモニウム
アンモニアとアンモニウムは窒素含有化合物です。どちらも、分子またはイオンあたり 2 つ以上の原子で構成される多原子化合物です。アンモニウムはアンモニアに由来します。アンモニアは気体として見つけることができますが、アンモニウムは物質の 3 つの相すべてで見つけることができます。化学組成はほぼ同じですが、アンモニアとアンモニウムには多くの違いがあります。アンモニアとアンモニウムの主な違いは、アンモニアは中性化合物であるのに対し、アンモニウムは陽イオンです。
対象となる主な分野
1.アンモニアとは
– 定義、化学構造、特性
2.アンモニウムとは
– 定義、化学構造、特性
3.アンモニアとアンモニウムの類似点は何ですか
– 共通機能の概要
4.アンモニアとアンモニウムの違いは何ですか
– 主な相違点の比較
キーワード:アンモニア、アンモニウム、アンモニウム塩、アザン、アザニウム、陽イオン、孤立電子対、多原子
アンモニアとは
アンモニアは、化学式 NH3 を持つ無機化合物です。 .それはガス状化合物です。アンモニアのモル質量は 17.031 g/mol です。この化合物はアルカリ性で、特有の刺激臭があります。アンモニアの IUPAC 名は azane です .
アンモニアの形状は三角錐です。ここで、三角錐は、窒素原子上の 3 つの N-H 結合と孤立電子対で構成されています。典型的な三角錐構造の分子の結合角は 109 ですが、孤立電子対の存在により、アンモニア分子の結合角は 107 に減少しています。
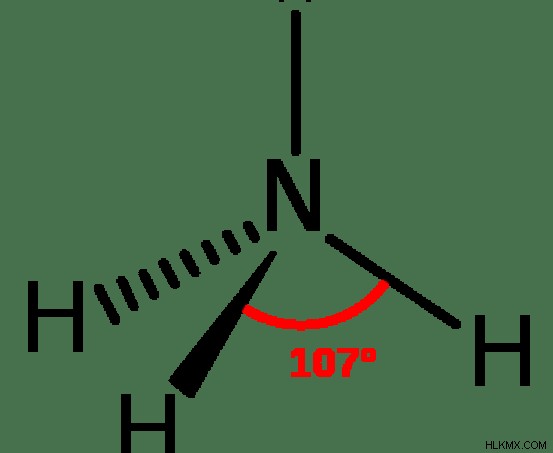
図 1:アンモニアの化学構造
アンモニアの融点は-77.73℃、沸点は約-33.34℃です。アンモニアの密度を考えると、空気より軽いです。この化合物には N-H 結合があるため、アンモニアは容易に液化してアンモニア液になります。これは、N-H 結合が互いに強い水素結合を形成できるためです。液体アンモニアが融点まで凍結すると、白い結晶が形成され始めます。
アンモニアは、水分子と水素結合を形成する能力があるため、水と混和します。水の沸点に比べてアンモニアの沸点は非常に低いため、アンモニア水を沸騰させると、水からアンモニアが排出されます。アンモニアは、酸素の存在下で燃焼することがあります。アンモニアの燃焼は、淡い黄色の炎として観察できます。
アンモニウムとは
アンモニウムは、化学式 NH4 を持つカチオンです。 .アンモニウムイオンは、窒素原子1個と水素原子4個からなる無機イオンです。 N-H結合が4つあります。アンモニウムイオンは多原子オンです。このカチオンのモル質量は 18.039 g/mol です。アンモニウム イオンの IUPAC 名は アザニウム です .
アンモニウムイオンは三角錐構造をしています。ここでは、4 つの N-H 結合が三角錐構造に配置されています。この分子ではすべての結合が類似しているため、結合角は 109 です。この分子は、アンモニア分子の窒素原子上の孤立電子対がプロトンに供与されたときに形成されます。陽子は、分子に正電荷を持たせます。アンモニウムイオンの窒素の酸化数は-3です。

図 2:アンモニウム イオンの化学構造
アンモニウムイオンは弱酸性です。塩基と反応してアンモニアガスを生成することがあります。アンモニアが水に溶けると、アンモニウムイオンができます。これは平衡反応であり、溶液の pH に大きく依存します。反応は次のとおりです。
H2 O + NH3 ⇌ OH + NH4
アンモニウムイオンは、アンモニウム塩によく見られます。アンモニウム塩は、アンモニウム陽イオンと無機陰イオンで構成される化合物です。アンモニウム塩のいくつかの例には、塩化アンモニウム、硫酸アンモニウム、および炭酸アンモニウムが含まれる。これらの塩化合物は水溶性が高いです。
アンモニアとアンモニウムの類似点
- どちらの化合物も窒素原子と水素原子で構成されています
- どちらも多原子化合物です
- 窒素原子は両方の化合物で +3 の酸化数を持っています
- どちらも三角錐の形状をしています
アンモニアとアンモニウムの違い
定義
アンモニア: アンモニアは、化学式 NH3 を持つ無機化合物です。 .
アンモニウム: アンモニウムは、化学式 NH4 を持つ陽イオンです。 .
孤立電子対
アンモニア: アンモニアには孤立電子対があります。
アンモニウム: アンモニウム イオンには孤立電子対がありません。
IUPAC
アンモニア: アンモニアの IUPAC 名は azane です .
アンモニウム: アンモニウム イオンの IUPAC 名は アザニウム です .
自然
アンモニア: アンモニアはアルカリ性化合物です。
アンモニウム: アンモニウムイオンは弱酸性です。
結合角度
アンモニア: アンモニアの結合角は 107°です。
アンモニウム: アンモニウム イオンの結合角は 109°です。
モル質量
アンモニア: アンモニアのモル質量は 17.031 g/mol です。
アンモニウム: アンモニウム イオンのモル質量は 18.039 g/mol です。
電荷
アンモニア: アンモニアは中性化合物です。
アンモニウム: アンモニウム イオンは +1 の電荷を持っています。
結論
アンモニアとアンモニウムは、窒素原子と水素原子で構成される 2 つの関連化合物です。アンモニウムイオンはアンモニアに由来します。アンモニアとアンモニウムの主な違いは、アンモニアが中性化合物であるのに対し、アンモニウムは陽イオンであることです.