主な違い シャペロンとシャペロニンの違いは、シャペロンは 共有結合によるフォールディングまたはアンフォールディング、および他の高分子構造の組み立てまたは分解を支援するタンパク質 一方、シャペロニンは分子シャペロンのクラスであり、 変性タンパク質の正しい折り畳みに好ましい条件を提供し、凝集を防ぎます。 さらに、シャペロンは分子量 70~100 kDa のモノマーであり、シャペロニンは分子量 800 kDa のオリゴマーです。
シャペロンとシャペロニンは、主にタンパク質の折り畳みを担う分子シャペロンタンパク質の 2 つのグループです。一般に、それらのほとんどは熱ショックタンパク質 (HSP) です。
対象となる主な分野
1. シャペロンとは
– 定義、構造、機能
2. シャペロニンとは
– 定義、構造、機能
3. シャペロンとシャペロニンの類似点
– 共通機能の概要
4. シャペロンとシャペロニンの違い
– 主な相違点の比較
主な用語
シャペロン、シャペロニン、変性タンパク質、熱ショックタンパク質 (HSP)、タンパク質フォールディング

シャペロンとは
シャペロンは分子シャペロンの一種で、タンパク質の折り畳みと組み立てを元の構造にします。さらに、それらは間違ったコンフォメーションを持つタンパク質のリモデリングを担っています。ほとんどのシャペロンは熱ショックタンパク質 (HSP) です。また、分子量が 70 ~ 100 kDa のモノマーでもあります。さらに、シャペロンの 3 つのファミリーは、Hsp70 ファミリー、Hsp90 ファミリー、および Hsp33 ファミリーです。
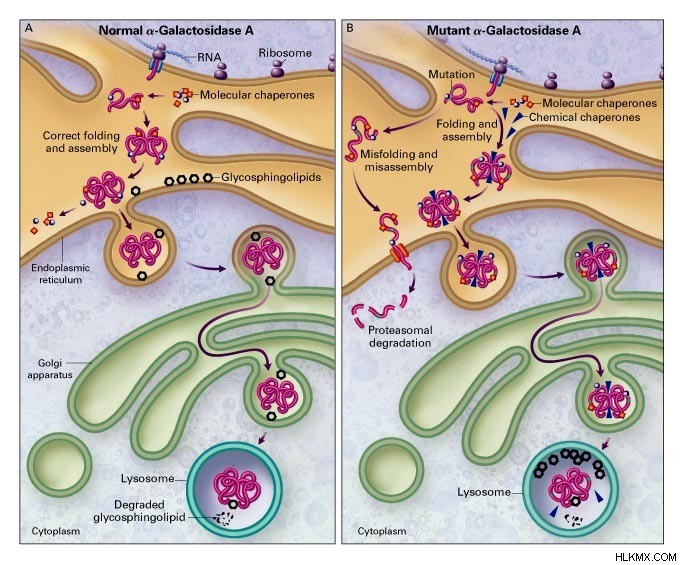
図 1:シャペロン機能
Hsp70ファミリー
Hsp70 ファミリーは、分子量が約 70 kDa のタンパク質 Hsp70 で構成されています。また、ATPase 活性を示します。重要なことに、サイトゾルでは、DnaK はバクテリアの Hsp70 のタイプであり、ストレス誘導性の Hsp72 と構成的である Hsp73 は、高等真核生物の Hsp70 のタイプです。一方、Hsp70はHsp40(細菌のDnaJ)およびGrpEと相互作用します。ここで、Hsp40 は ATP の加水分解を刺激し、GrpE はヌクレオチド交換の因子として機能します。
Hsp90ファミリー
Hsp90 ファミリーは、Hsp70 ファミリーほど代表的ではありません。さらに、細胞にはストレス依存性のHsp90が大量に含まれています。 HtpG は細菌の Hsp90 ファミリーのタンパク質です。
Hsp33ファミリー
Hsp33 ファミリーには、アクティブなシステインと Zn が含まれています。合成は熱ショックによって誘導され、酸化ショックによって活性化されます。
さらに、シャペロンは foldases または holdases のいずれかです。ここで、 foldases は ATP 依存的にタンパク質のフォールディングを支援します。フォルダーゼの例には、GroEL/GroES、DnaK、DnaJ、および GrpE が含まれます。対照的に、ホールダーゼは、フォールディング中間体に結合することにより、フォールディング中間体の凝集を防ぐ役割を果たします。
シャペロニンとは
シャペロニンは分子シャペロンのもう 1 つのタイプで、特に変性タンパク質の正しい折り畳みを支援します。シャペロニンの最大の特徴はその形状です。一般に、シャペロニンは 7、8、または 9 個のモノマー単位を持つ 2 環構造を持っています。したがって、シャペロニンは分子量 800 kDa のオリゴマーです。一方、シャペロニンの 2 つのファミリーには、Hsp60 ファミリーと TRiC ファミリーが含まれます。
Hsp60ファミリー
細菌では、Hsp60 ファミリーはタンパク質 GroEL で構成されています。GroEL は、それぞれ 60 kDa の 7 つのサブユニットからなる 2 つのリング を持っています。さらに、ATPアーゼ活性を持っています。また、GroELの補因子はGroESであり、ポリペプチドの折り畳みを促進します。一方、高等真核生物では、Hsp60 とその補因子である Hsp10 が Hsp60 ファミリーのタンパク質です。これらのタンパク質は、ミトコンドリアにも存在します。ただし、Cpn60 および Cpn20 と呼ばれる Hsp60 ファミリーのタンパク質は、高等真核生物の葉緑体に存在します。
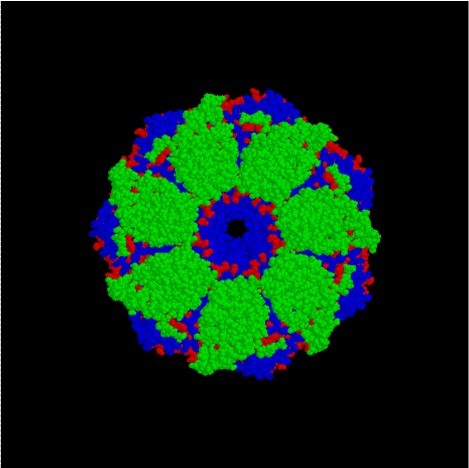
図 2:GroEL/GroES タンパク質複合体
TRiCファミリー
TRiC ファミリーには、それぞれ 55 kDa のサイズの 8 つのサブユニットからなる 2 つのリングを持つ TRiC タンパク質が含まれます。さらに、それは細菌と高等真核生物の両方のサイトゾルで発生します。
シャペロンとシャペロニンの類似点
- シャペロンとシャペロニンはタンパク質の 2 つのグループです、タンパク質の折り畳みと展開を助けます。
- さらに、組み立てと分解を支援しますタンパク質の。
- したがって、それらの主な機能は、タンパク質の恒常性。
- これらのタンパク質は、進化の過程で高度に保存されています。
- さらに、ATPase 活性を示します。
- それらのほとんどは熱ショックタンパク質 ( HSP)。
シャペロンとシャペロニンの違い
定義
シャペロンは、他の高分子構造の共有結合フォールディングまたはアンフォールディング、アセンブリおよび分解を支援するタンパク質を指し、シャペロニンは、変性タンパク質の正しいフォールディングのための好ましい条件を提供するタンパク質を指します、凝集を防ぎます。したがって、これがシャペロンとシャペロニンの根本的な違いです。
サイズ
シャペロンは分子量 70 ~ 100 kDa のモノマーですが、シャペロニンは分子量 800 kDa のオリゴマーです。
形
シャペロンのほとんどは熱ショックタンパク質 (HSP) ですが、シャペロニンは 2 つのドーナツを重ねて樽を作ったような形をしています。
機能
さらに、シャペロンとシャペロニンのもう 1 つの違いは、シャペロンがタンパク質のフォールディング、アンフォールディング、アセンブリ、および分解を担当しているのに対し、シャペロニンはタンパク質の正しいフォールディングを担当していることです。凝集を防ぐ変性タンパク質。
例
シャペロンには、DnaK、DnaJ、GrpE、HtpG、および Hsp33 が含まれ、シャペロニンには、GroEL/GroES および TRiC が含まれます。
結論
簡単に言うと、シャペロンは分子シャペロン タンパク質のグループで、タンパク質の本来の構造へのフォールディング、アンフォールディング、アセンブリ、分解 に関与しています。また、その多くはヒートショックプロテインです。さらに、それらはサイズが 70 ~ 100 kDa のモノマーです。一方、シャペロニンは、変性タンパク質の正しい折り畳みに関与する分子シャペロンタンパク質のもう 1 つのタイプです。さらに、これはタンパク質の凝集を防ぎます。シャペロニンは 2 環構造のオリゴマーで、分子量は 800 kDa です。したがって、シャペロンとシャペロニンの主な違いは、それらの構造と機能です。