コア コンセプト
このチュートリアルでは、酸解離定数 (Ka) と、化学の他のトピックへの応用について学びます。 Ka と pKa を関連付ける方法と、Ka と PH の関係について学びます。
他の記事で取り上げるトピック
- バッファ容量と計算
- モル濃度とモル濃度式の計算方法
- 水の物理的および化学的性質
- 平衡定数とは
- 酸塩基中和反応
カーとは?
Ka、または酸解離定数は、強酸と弱酸を区別するために使用されます。酸がより多く解離する場合、Ka の値は減少し、酸が水中で解離する可能性が低い場合、Ka 値は低くなります。したがって、たとえば、塩酸 (HCl) のような強酸は、弱酸のフッ化水素酸 (HF) よりも高い解離定数 Ka を持ちます。これは、弱酸は水中でイオン化する可能性が低く、ほとんどが分子として存在するのに対し、強酸は水中でほとんどがイオンとして存在するためです.
Ka は、酸の解離反応の平衡定数でもあります。これは、溶液中の酸の強さの定量的な値です。酸解離定数には単位がありません。
Ka は反応物上の生成物に等しい .
Ka の計算手順
Ka を計算する手順は次のとおりです:
<オール>元。 HBr → H+Br
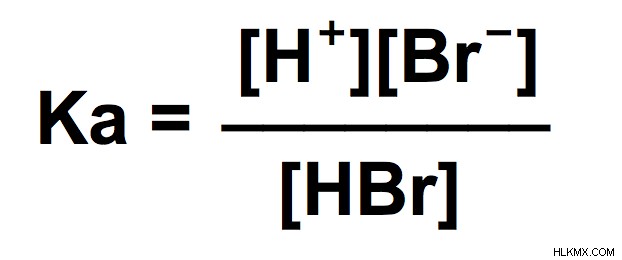
水素イオン、臭素イオン、および臭化水素酸を囲む括弧は、モル濃度を示します。したがって、この反応の Ka の定量的な値を見つけるには、これらの各項目のモル濃度が必要です。
基本的に、Ka の値が高いほど、酸は解離します。酸が解離すればするほど、酸は強くなります。酸が強いほど、Ka 値が高くなります。対照的に、弱い酸は一般に強い酸よりも Ka 値が低くなります。これは、弱酸は部分的にしか解離しないため、生成物よりも多くの反応物が存在することを意味します。
平衡値 (K 値)
反応の平衡値は、反応物で割った反応の生成物の比率を示します。反応の K 値が高い場合、反応は生成物に有利に働き、序文の方向に進みます。同様に、反応の K 値が低い場合、反応は反応物に有利に働き、逆方向に進行します。
酸塩基反応
酸塩基反応の Ka は、反応物と生成物の pKa 値がわかっている場合に計算できます。共役酸と反応酸の PKa 値の差を 10 乗します。

反応に弱い共役酸と強い反応酸がある場合、平衡定数は高くなります。これは、反応がほぼ完全に進行することを意味します。逆に、酸塩基反応の共役酸が強酸の場合、平衡定数は信じられないほど低くなります。
Ka から Ph を計算する
酸解離定数の値は、さまざまなシナリオで使用できます。場合によっては、Ph の計算に使用できます。HBr の 0.20M 溶液の例を使用してみましょう。
- 最初のステップは、H イオンを形成するイオン化の化学反応を記述することです – HBr ⇌H+ Br
- 2 番目のステップは、この反応の平衡式を書くことです。これは、反応物に対する生成物です。
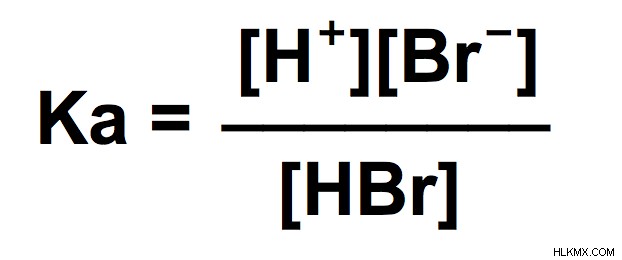
- 次に、既知のものを使用して ICE を作成します。 水素イオンの濃度を解くグラフ。
| イニシャル | 0.20 M | 0 | 0 |
| 変化 | -x | +x | +x |
| 均衡 | (.20 – x)M | x | x |
- ICE チャートを作成したら、これらの値を使用して X を定義する必要があります。上記の平衡式を使用して値を入力し、X を解きます。これにより、水素イオンの濃度の値が得られます。
- 最後に、PH の式は -log[H] に等しいため、 PH は 5.00 に等しいことがわかります。
pKa と Ka の関係
pKa と Ka の値は、通常、酸が溶液中でどの程度イオン化するかを決定する際に最も役立ちます。酸解離定数と同様に、Kb は塩基解離定数です。酸解離定数と塩基解離定数は、水のイオン定数 Kw によって関連付けられます。
したがって、 Ka x Kb =Kw
化学で定数の前に小文字の p がある場合、通常 その値の平均 - ログ。 Ka が酸解離定数であることがわかっているので、pKa は単に酸解離定数値の -log を意味します。酸は通常、次の式に従って解離します。
HA + H2 O ⇆ A + H3 O (文字 A は酸を表します)
Ka =[H+][A-]/[HA] (スラッシュは除算を表します)。ここで、反応物に対する反応の生成物を見ることができます。
pKa =– log Ka (前の質問で Ka の値を取得したので、pKa の値を見つけることができることに注意してください)。
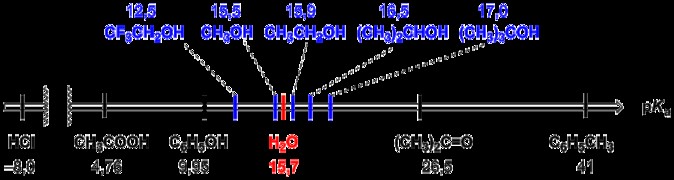
酸はほぼ完全に解離しているため、強酸は酸解離定数の値が大きくなることに以前からお気づきかもしれません。酸のイオン化された形は強酸の解離に有利に働くため、反応は左側 (反応の側) に進みます。 pKa は逆の順序で同じことを教えてくれます。したがって、pKa が小さいほど酸が強いことを示します。