- 塩酸(HCl) - 水中で完全にイオン化し、H+イオンを放出する強酸。
- 酢酸(CH3COOH)のような有機酸 - 水中で部分的にイオン化する弱酸を限定されている程度まで供給します。
ベース: 塩基は、化学反応で陽子を受け入れることができる化学種です。彼らは他の分子を脱プロトン化する能力を持っています。例は次のとおりです。
- 水酸化ナトリウム(NAOH) - 水中の水酸化物(OH-)イオンを放出する強力な塩基。
- アンモニア(NH3) - 陽子を受け入れ、その共役酸、アンモニウム(NH4+)を形成できる弱い塩基。
酸と塩基の識別:
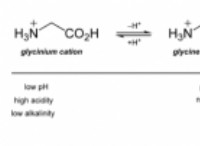
1。 pHスケール :これは、溶液の酸性度または塩基性を直接決定するための有用な測定です。低いpH(<7)は、H+イオンの濃度が高いことを示し、酸性度を示しますが、より高いpH(> 7)はより多くのオハイオンを意味し、基本的な解を示します。
2。指標との反応 :Litmus PaperやPhenolphthaleinなどの指標は、酸性または塩基の存在下で色の変化を起こし、視覚的な手がかりを提供します。たとえば、赤いリトマスの紙は基本的な溶液で青く変わり、青いリトマス紙は酸性条件で赤くなります。
3。酸塩基中和反応 :酸と塩基が反応すると、それらは互いに中和します。これは、酸性溶液と基本的な溶液の組み合わせがニュートラル溶液をもたらす場合、通常は7に近いpHで識別できます。
4。導電率 :酸と塩基は、水に溶解すると、溶液の電気伝導率を高めるイオンを放出します。したがって、導電率の変化を測定すると、酸または塩基の存在を示すことができます。
5。味と触れてください :標準的な科学的方法ではありませんが、一部の酸は酸っぱい味に関連しています(レモンのクエン酸を考えてください)が、塩基はしばしば滑りやすい、または触ってせっけんを感じます。
反応条件に応じて酸またはベースのいずれかとして振る舞うことができる水(H2O)などの両性物質も存在することは注目に値します。酸または塩基を正確に識別するために、化学反応のコンテキストを考慮することが重要です。