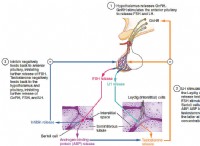
原子の各電子は、特定のエネルギーレベルまたは電子シェルを占めます。シェルは核の周りに集中的に配置されており、最も内側のシェルは核に最も近く、最も外側のシェルは最も遠いものです。核からの距離が増加すると、エネルギーレベルが上昇します。電子は離散エネルギーレベルのみを占めることができ、許容されるエネルギーレベルは電子軌道に関連する量子数によって決定されます。
主要な量子数(n)は、電子が占有する主なエネルギーシェルを決定し、n =1は最も内側のシェルに対応し、n =2に2番目のシェルに対応します。角運動量量子数(L)は、特定のシェル内の電子軌道の形状を決定します。各メインエネルギーシェルは、異なる角運動量量子数を持つ複数のサブシェルを持つことができます。磁気量子数(ml)は、空間内の電子軌道の方向を表します。最後に、スピン量子数(MS)は、電子の2つのスピン状態を指定します。
要約すると、電子は電子と核の間の静電力のために、原子の殻の上にあります。それらの分布は量子力学によって支配されており、電子は離散エネルギーレベルと量子数によって決定される軌道を占めています。このシェル構造は、原子と分子の化学的性質と挙動を決定する上で重要な役割を果たします。