主な違い – 水素と酸素
元素の周期表は、これまでに地球上で発見されたすべての元素を原子番号 (昇順) に従って示しています。これらの元素の一部は地球上に非常に豊富に存在しますが、他の元素は微量しか見つかりません。水素と酸素は、地球上のほとんどどこにでも存在する 2 つの元素です。水素と酸素の主な違いは、水素の最安定同位体には中性子がないのに対し、酸素の最安定同位体には 8 つの中性子があることです。
対象となる主な分野
1.水素とは
– 定義、同位体、構造、特性、存在量
2. 酸素とは
– 定義、同位体、構造、特性、存在量
3.水素と酸素の違いは何ですか
–主な違いの比較
重要な用語:同素体、原子番号、電子、水素、同位体、中性子、酸素、陽子、プロチウム 
水素とは
水素は原子番号1の元素です と記号 H .周期表の一番上にある元素です。水素には 3 つの天然の同位体があります。 それらは、プロチウム、重水素、およびトリチウムです。それらは、核内にある中性子の数が互いに異なります。これらの同位体の中で、最も一般的に見られる同位体はプロチウムです .自然界におけるプロチウムの存在量は約 98% です。したがって、水素という用語は通常、プロチウムを指します。
水素には中性子がなく、陽子が 1 つ、電子が 1 つしかありません。水素には が 1 つしかありません 軌道であり、他の軌道はありません。したがって、水素原子が持つ唯一の電子は s 軌道にあります。この電子は単独で対になっていないため、水素はこの電子を取り除くことで容易に H イオンを形成できます。不対電子が存在すると、水素原子が不安定になります。したがって、水素は、電子を共有することによって、多くの異なる元素と共有結合を形成する傾向があります。
自然界で見られる水素の最も一般的な形態は水分子です。 2 つの水素原子は、水分子内の 1 つの酸素原子と共有結合しています。水の分子式はH2 O.それとは別に、水素は炭化水素、多くの一般的なポリマー、その他の有機および無機種に含まれています。水素は、水素ガスとして大気中に存在します。水素ガスの分子式はH2 .そこでは、2 つの水素原子が共有結合を介して、それらが持つ唯一の電子を共有することによって接続されています。
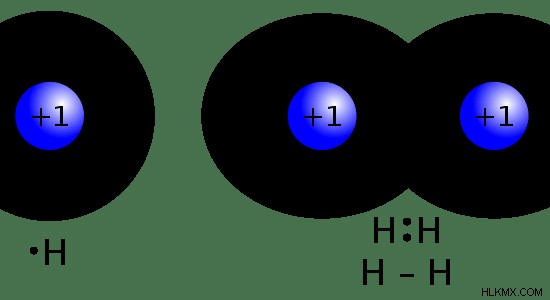
図 01:H と H2 の化学構造
標準の温度と圧力では、水素は無色、無臭、無毒の気体です。可燃性が高い。 H2のとき ガスは金属元素と反応し、ハニオンを形成します。この陰イオンは水素化物と呼ばれます。金属と水素化物の結合はイオン性であり、水素原子は水素化物陰イオンに 2 つの電子 (ペア) を持っています。
酸素とは
酸素は原子番号8の元素です と記号 O .自然に発生する酸素には 3 つの同位体があります。それらは O、O、および O です。しかし、最も豊富な形態は O です。したがって、一般的に酸素について話すときは、O 同位体を指します。
酸素の原子核には 8 つの陽子と 8 つの中性子があります。また、原子核の周りに 8 個の電子があります。これらの電子は、s軌道とp軌道にあります。酸素の電子配置は1s2s2pです。電子を含む最も外側の軌道が p 軌道であるため、酸素は周期表の p ブロックに属します。酸素は2p軌道に4個の電子を持っています。そのうちの 2 つは対になっており、他の 2 つの電子は不対になっています。したがって、酸素は外部から2つの電子を取得することでOアニオンを作ることができます。 2 つの電子が得られると、酸素は非常に安定した配置である Neon の電子配置になります。
酸素フォーム O2 ガス。それは、すべての生物が呼吸のために必要とするガスです。 O2 のパーセンテージ 大気中のガスは約 21% です。したがって、酸素は大気中に最も豊富に存在します。酸素は水分子の一部としても見られます。そこでは、酸素原子が共有結合を介して 2 つの水素原子と結合しています。酸素は 2 番目に電気陰性度が高く、フッ素に次いで 2 番目です。
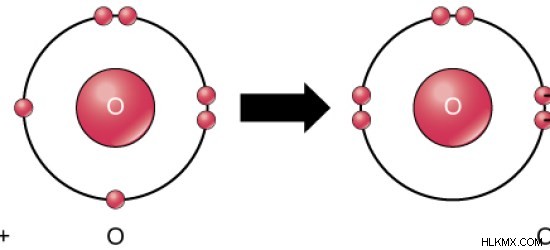
図 02:O2 分子の形成
標準の温度と圧力では、酸素は無色、無臭、無毒の二原子分子として発生します。酸素には O2 の同素体が 2 つあります。 そしてO3 . O2 通常、O3 に対し、二酸素または酸素と呼ばれます。 オゾンといいます。オゾンは主に上層大気のオゾン層に存在します。
水素と酸素の違い
定義
水素: 水素は、原子番号 1 で記号 H の元素です。
酸素: 酸素は原子番号 8、記号 O の元素です。
中性子の数
水素: 水素の最も一般的な同位体は、原子核に中性子を持っていません。
酸素: 酸素の最も一般的な同位体は、原子核に 8 個の中性子を持っています。
軌道
水素: 水素には s 軌道が 1 つしかありません。
酸素: 酸素には s 軌道と p 軌道があります。
不対電子の数
水素: 水素には不対電子が 1 つあります。
酸素: 酸素には 2 つの不対電子があります。
共有結合の数
水素: 水素は共有結合を 1 つしか形成できません。
酸素: 酸素は 2 つの共有結合を形成できます。
原子量
水素: 水素の原子質量は約 1.00794 u です。
酸素: 酸素の原子量は 15.999 u です。
結論
水素と酸素の両方が地球の地殻に非常に豊富に存在します。したがって、水素と酸素の違いを理解することが重要です。これらの元素は、二原子分子として気相に存在するか、他の元素と結合して固相または液相として存在します。