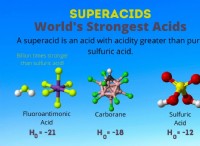
HFは、水素(2.1)とフッ素(4.0)の間の電気陰性度の有意差があるため、極性分子です。この極性は、水素原子の部分的な正電荷とフッ素原子の部分的な負電荷をもたらします。電気陰性のフッ素原子は、電子をそれ自体に引き付け、強い極結合を作り出します。
2。高い結合解離エネルギー:
HFのH-F結合は、565 kJ/molの高い結合解離エネルギーを持っています。これは、結合を破り、水素とフッ素原子を分離するためにかなりの量のエネルギーが必要であることを意味します。高い結合解離エネルギーはHFの安定性に寄与し、水中のH+およびF-イオンに解離する可能性が低くなります。
3。フッ化物イオンの小さいサイズ:
フッ化物イオン(F-)は、その電気陰性度が高いため、サイズが非常に小さく、電子をしっかりと保持することができます。フッ化物イオンのサイズが小さいため、電荷密度が高くなり、強いベースになります。これは、F-イオンが水中のH+イオンを安定化するのにあまり効果的ではなく、HFの解離とH+イオンの放出につながることを意味します。
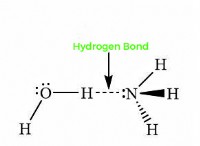
4。水素結合:
HF分子は、水分子との水素結合に関与することができます。水素結合には、高強性原子(Fなど)と別の電気陰性原子(Oなど)に共有結合した水素原子との間の分子間結合の形成が含まれます。これらの水素結合は、HF分子を安定させ、HFの酸性度をさらに高めるのに役立ちます。
要約すると、HFの酸性度は、H-F結合の極性、高い結合解離エネルギー、フッ化物イオンの小さなサイズ、および水素結合に関与するHFの能力に起因する可能性があります。これらの要因は、水中のHFの部分イオン化に集合的に寄与し、H+イオンの放出をもたらし、HFを酸性化合物にします。