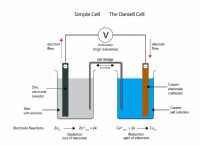
1。電極電位:
- 標準電極電位(E°): これは、標準的な水素電極(SH)と標準条件(25°Cの温度、1Mの濃度、1気圧の圧力)の下での残りの半細胞電極の間の電位差です。標準電極電位は、電極が酸化または還元を受ける傾向の尺度です。
- nernst方程式: Nernst方程式は、濃度や温度の変化などの非標準的な条件を考慮し、標準電極電位を変更します。 NERNST方程式は次のように与えられます。
`` `
e =e° - (0.0592/n)log q
`` `
ここでは、Eは非標準条件下では電極電位です。E°は標準電極電位、Qは反応商、nはバランスのとれた半反応で伝達される電子のモル数、0.0592 Vは温度とファラデー定数に関連する定数です。
2。反応物と生成物の濃度:
- ハーフ反応に関与する反応物と生成物の濃度は、電圧細胞の電圧に影響します。 Nernst方程式によれば、反応物の濃度が高く、濃度の濃度が低くなると、細胞の電圧が増加します。
3。温度:
- 温度は、化学反応の速度と反応物と生成物の活性に影響します。エントロピーの変化(ΔS)がより高い温度でより有利になるため、温度の上昇は通常、細胞の電圧を増加させます。
4。電極の表面積:
- 電極の表面積は、電気化学反応の速度に役割を果たします。表面積が大きくなると、より多くの反応が同時に行われ、細胞の電圧が高くなります。
5。溶液中のイオン強度とイオン種:
- 電解質溶液中の他のイオンの存在は、反応物と生成物の活性係数に影響を与え、電圧に影響を与えます。不活性電解質(KNO3など)を追加すると、高いイオン強度を維持し、活性係数の変化を最小限に抑え、より安定した細胞電圧測定につながります。
6。参照電極:
- 基準電極(通常は標準の水素電極または彼女)は、他の電極(作動電極)の電位が測定される安定したポテンシャルを提供します。参照電極は、一定の電位を維持し、正確な測定を可能にします。
7。細胞設計:
- 電極間の距離、使用される電解質の種類(水または非水性)、電極材料、細胞設計などの要因も、電圧細胞の電圧に影響を与える可能性があります。
要約すると、電圧セルの電圧は、ハーフセルの標準電極電位、反応物と生成物の濃度、温度、電極の表面積、溶液中の他のイオンの存在、参照電極の選択、および全体的な細胞設計によって決定されます。