主な違い - 加水分解と水和
加水分解は、水分子を分割し、化合物内の化学結合を破壊することによって、化合物に水分子を付加することです。したがって、加水分解は複分解反応とみなされます。水和という用語には、有機化学と無機化学の 2 つの異なる用途があります。有機化学では、アルケンまたはアルキンへの水分子の付加です。しかし、無機化学では、水和は、水分子を切断することなく、水分子の会合または結合です.したがって、加水分解と水和の主な違いは、加水分解には水分子の分割が含まれるのに対し、水和には常に水分子の分割が含まれるとは限らないことです。 .
対象となる主な分野
1.加水分解とは
– 定義、さまざまなタイプ
2.水分補給とは
– 有機および無機化学における定義、応用
3.加水分解と水和の違いは何ですか
– 主な相違点の比較
重要な用語:アルケン、アルキン、Brønsted-Lowry 酸塩基理論、分解反応、水和、加水分解、溶解度定数

加水分解とは
加水分解は、水を反応物の 1 つとする二重分解反応です。つまり、水分子を使って分子内の結合を切ることです。加水分解反応はしばしば可逆的です。加水分解反応には主に 3 つのタイプがあります:
<オール>Brønsted-Lowry 酸理論によれば、水は酸または塩基として作用することができます (この理論によれば、酸と塩基が互いに反応すると酸が形成されます。その共役塩基、および塩基はプロトンの交換によってその共役酸を形成します)。水が Brønsted-Lowry 酸として作用する場合、水分子はプロトンを供与します。それがブレンステッド・ローリー塩基として作用する場合、水分子はプロトンを受け入れることができ、ヒドロニウムイオン (H3 O)。 酸加水分解 酸解離反応に似ています。
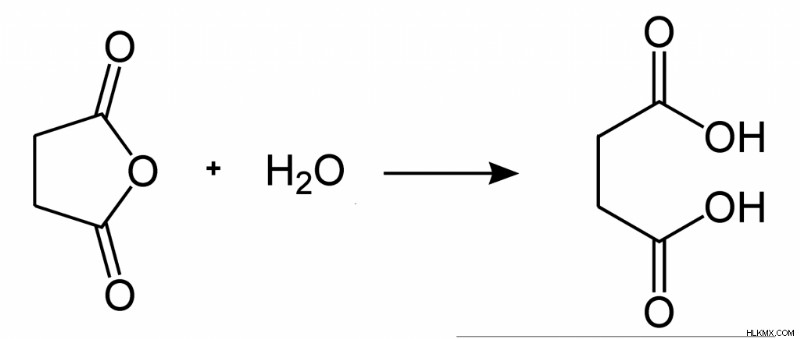
図 1:無水コハク酸の加水分解
塩基加水分解 塩基解離反応に似ています。ここで、水はプロトンを供与し、水酸化物アニオン (OH) を生成します。したがって、水は Brønsted-Lowry 酸として機能します。
塩が水に溶けると、塩はイオンに解離します。この解離は、溶解度定数に基づいて、完全な解離または不完全な解離のいずれかである可能性があります。しかし、弱酸または弱塩基の塩が水に溶解すると、水は塩をイオン化し、水酸化物陰イオンとヒドロニウム陽イオンを形成します。塩も陽イオンと陰イオンに分かれます。これは塩の加水分解として知られています .
ハイドレーションとは
水和は、水分子が物質と結合する化学プロセスです。有機化学では、水和とは、不飽和化合物、アルケンまたはアルキンへの水分子の付加を指します。しかし、無機化学では、水和とは水分子と化合物との結合を指します。
有機化学では、水分子は不飽和が存在するポイントに追加されます。ここで、水分子は陽子と水酸化物陰イオンに分解します。水酸化物アニオンは、より多くの置換基を持つ炭素原子と結合を形成します。陽子は、マルコフニコフの法則に従って、置換の少ない炭素と結合します。不飽和有機分子は水和の影響を受けやすい.
無機化学では、水和とは水分子と無機化合物との会合を指します。たとえば、TiO2 の製造のための硫酸塩プロセス イルメナイト砂からの顔料 (FeTiO3 )、副産物として FeSO4 が形成されます。水和による結晶化によるこの副産物。ここで、FeSO4 .7H2 OはFeSO
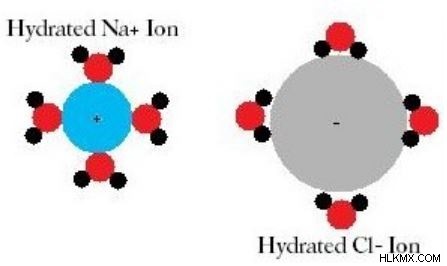
図 2:水和ナトリウム カチオンと塩化物アニオン
水分補給は、乾燥剤で発生する化学プロセスです。乾燥剤は、水蒸気を吸収できる化合物です。さらに、水和という用語は、ナトリウムイオンなどの塩イオンの溶解を説明するためにも使用されます。塩が水に溶けると、塩は陽イオンと陰イオンに解離します。これらの陽イオンと陰イオンは、水分子によるイオンの水和により互いに分離されます。ここで、水分子が塩イオンを取り囲みます。これは水和と呼ばれます。
加水分解と水和の違い
定義
加水分解: 加水分解は、水を反応物の 1 つとする二重分解反応です。
水分補給: 水和は、水分子が物質と結合する化学プロセスです。
化学結合
加水分解: 加水分解は、水分子の結合切断により発生します。
水分補給: 有機分子の水和は結合の開裂を伴いますが、無機化合物では開裂は起こりません。
自然
加水分解: 加水分解は、不飽和化合物から飽和化合物を形成します。
水分補給: 水和は、脱水化合物から水和化合物を形成します。
結論
加水分解と水分補給は、学生がよく混同する 2 つの異なる用語です。加水分解と水和の主な違いは、加水分解には水分子の分割が含まれるのに対し、水和には常に水分子の分割が含まれるとは限らないことです。
参照:
1.「加水分解」。ブリタニカ百科事典、ブリタニカ百科事典、2016 年 11 月 16 日、こちらから入手可能。
2.「加水分解」。 Chemistry LibreTexts、Libretexts、2016 年 7 月 21 日、こちらから入手可能。
3.「加水分解」。ウィキペディア、ウィキメディア財団、2018 年 1 月 24 日、こちらから入手可能。
画像提供:
1.「無水コハク酸の加水分解」Drdoht (トーク) 2016 年 2 月 21 日 00:26 (UTC) – Commons Wikimedia による自身の作品 (パブリック ドメイン)
2. Kkeyshar による「水和」 – 自身の作品 (パブリックドメイン) コモンズ ウィキメディア経由