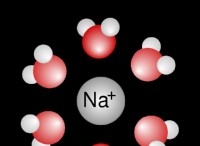
* イオン化合物 :水酸化ナトリウム(NaOH)は、正に帯電したナトリウム(Na+)イオンと負に帯電した水酸化物(OH-)イオンで構成されるイオン化合物です。
* 極水分子 :水は極性分子です。つまり、一方の端(水素原子)にわずかな正電荷と、もう一方の端(酸素原子)にわずかな負電荷があります。
* 引力 :水酸化ナトリウムを水に溶解すると、陽性ナトリウムイオンは水の負の酸素原子に引き付けられ、負の水酸化物イオンは水の陽性水素原子に引き付けられます。イオンと水分子の間のこれらの引力は、静電力またはイオン双極子相互作用と呼ばれます。
強い水分補給エネルギー:
* 水分補給シェル :極水分子は、ナトリウムと水酸化物イオンを囲み、溶媒補給し、その周りに水和シェルを形成します。正に帯電したナトリウムイオンは、負の酸素原子の殻に囲まれていますが、負に帯電した水酸化物イオンは、陽性水素原子の殻に囲まれています。
* 水分補給エネルギー :イオンが水分子に囲まれたときに放出されるエネルギーは、水分補給エネルギーとして知られています。ナトリウムと水酸化物イオンは、イオンと水分子の間の静電的相互作用が強いため、比較的高い水分補給エネルギーを持っています。水分補給中に放出されるエネルギーは、格子エネルギー(固体水酸化ナトリウム結晶でイオンを分離するために必要なエネルギー)を克服し、化合物が水に容易に溶解できるようにします。
* 高い溶解度 :水酸化ナトリウムの極性とその強い水和エネルギーの組み合わせにより、水への溶解度が高くなります。イオンと水分子の間の強い静電力は、溶液が飽和する前に、かなりの量の水酸化ナトリウムを水に溶解できるようにします。
要約すると、水中の水酸化ナトリウムの高い溶解度は、化合物の極性の性質に起因する可能性があります。この性は、イオン(Na+とOH-)と水分子の間の強い静電相互作用(イオン双極子相互作用)を可能にし、高い水分補給エネルギーを引き起こし、最終的に高度の溶解度をもたらします。