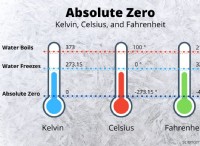
ナトリウムと水の間の反応は、次の化学式で表すことができます。
2na(s) + 2h2o(l)→2naoh(aq) + h2(g)
この式で:
-Na(s)は固体ナトリウムを表します。
-H2O(L)は液体水を表します。
-NAOH(AQ)は水酸化ナトリウムを表します。これは反応の産物として形成され、水に溶解して基本的な溶液を形成します。
-H2(g)は、反応の産物でもあり、ガスとして放出される水素ガスを表します。
反応中、金属内のナトリウム原子は最も外側の電子を急速に失い、正に帯電したナトリウムイオン(Na+)になります。これらのナトリウムイオンは、水分子内の負に帯電した酸素原子に引き付けられ、化学結合を形成し、水酸化ナトリウム(NAOH)の形成をもたらします。
同時に、水分子の水素原子は、ナトリウムによって失われた電子を獲得し、中性水素原子になります。これらの水素原子は結合して水素ガス(H2)を形成し、周囲の大気に泡として放出されます。
ナトリウム水反応は非常に発熱性であり、かなりの量の熱を放出することを意味します。解放された熱により、水が急速に沸騰し、蒸気を生成する可能性があります。反応には、高温とそれが可燃性の水素ガスの放出により、炎と火花を伴うこともあります。
その非常に反応性のある性質のため、特に水が存在する場合、ナトリウムは注意して処理する必要があります。ナトリウムを乾燥した環境に保存し、水との直接接触を避けて、潜在的に危険な反応の発生を防ぐことが重要です。