主な違い – 疎水性分子と親水性分子
水は、私たちが知っているほとんどの化合物を溶解するためのよく知られた溶媒です。しかし、自然界のすべての化合物が水と混ざり合うわけではありません。水と混合できる物質は親水性物質と呼ばれます。水と混合できない物質は、既知の疎水性物質です。これは、主に水分子の極性が原因で発生します。非極性化合物は極性溶媒に溶解できません。ここで、「似たものは似たように溶ける」という事実を考慮する必要があります。極性化合物は極性溶媒に溶解できます。非極性化合物は、非極性溶媒に溶解します。したがって、親水性物質が水に溶けるためには、極性がなければなりません。疎水性分子と親水性分子の主な違いは、疎水性分子は非極性であるのに対し、親水性分子は極性であることです。
対象となる主な分野
1. 疎水性分子とは
– 定義、プロパティ、および例
2.親水性分子とは
– 定義、プロパティ、および例
3.疎水性分子と親水性分子の違いは何ですか
– 主な相違点の比較
重要な用語:親水性、親水性、疎水性、疎水性、無極性、極性、水 
疎水性分子とは
疎水性分子は、水に溶解しない分子です。したがって、これらの分子は水分子をはじきます。これらの疎水性分子は疎水性物質と呼ばれます .疎水性は、分子がどの程度疎水性であるかを表します。
疎水性分子は、極性がないため疎水性です。言い換えれば、疎水性分子は非極性です。したがって、疎水性分子は、多くの場合、分子を非極性にする長鎖炭化水素基で構成されます。

図 1:疎水性
疎水性分子が水に加えられると、これらの分子は、水との接触を最小限に抑えるために、塊のように見えるミセルを形成する傾向があります。しかし、水分子はこれらの塊の周りに配置され、かごを形成します。この塊が形成されると、水分子間の水素結合が分解され、塊のためのスペースが作られます。化学結合が分解されるため、これは吸熱反応です。さらに、塊の形成により、システムのエントロピーが減少します。
熱力学的関係によると、
ΔG =ΔH – TΔS
ここで、ΔG はギブスの自由エネルギーです
ΔH はエンタルピーの変化
T は温度です
ΔS はエントロピーの変化です。
疎水性分子を水に加えると、ΔS が減少します。したがって、TΔSの値は減少する。吸熱反応なので、ΔHは正の値です。したがって、ΔG の値は大きな正の値である必要があります。正の ΔG 値は、反応が自発的ではないことを示します。したがって、水への疎水性分子の溶解は非自発的です。
疎水性分子間で起こる相互作用は、非極性分子であるため、ファン デル ワールス相互作用です。これらの相互作用には、疎水性相互作用という特定の名前が付けられています。水中に存在する塊は、水との接触をさらに最小限に抑えるために、互いに相互作用して混合する傾向があります。塊を取り囲む水分子間の水素結合が分解されるため、この反応のエンタルピーの変化は正の値になります。塊が入っていたケージが分解されて疎水性物質が解放されるため、システムのエントロピーが増加します。全体のプロセスを考慮すると、ΔG 値は負の値になります。したがって、疎水結合の形成は自発的です。
親水性分子とは
親水性分子は、水に溶ける分子です。つまり、親水性分子は水分子を引き付けます。分子の親水性は、その親水性として説明できます。親水性分子は極性分子です。水分子は極性分子であり、極性分子が水に溶解することを可能にします。これらの親水性分子は親水性と呼ばれます .
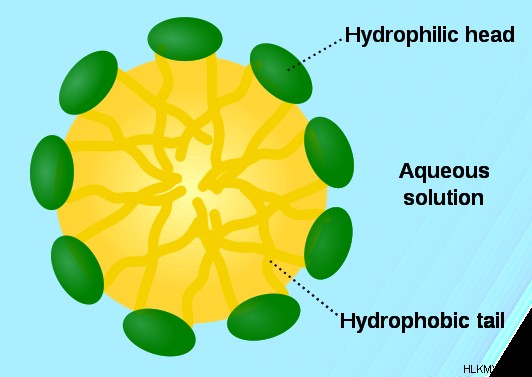
図 1:ミセルの形成。ここでは、親水性部分が水を引き寄せるため、親水性部分が外側を向いています。
親水性分子は、水分子と化学結合を形成できます。これらの親水性分子が O-H、N-H のような結合で構成されている場合、水分子と水素結合を形成し、水と混合することができます。熱力学的関係によると、
ΔG =ΔH – TΔS
親水性分子と水との混合により系のエントロピーが増加し、エントロピーの変化 ΔS は正の値になります。親水性物質と水分子の間に新しい結合が形成されるため、この混合は発熱します。その場合、エンタルピーの変化は負の値になります。したがって、ギブスの自由エネルギーは負の値であり、混合が自発的であることを示しています。
親水性物質の親水性によって、これらの分子がどれだけ水に溶けるかが決まります。分子の極性は、化学結合内の原子の電気陰性度の値の違いにより発生します。差が大きいほど、極性が高くなります。次に、親水性を高くします。
疎水性分子と親水性分子の違い
定義
疎水性 分子: 疎水性分子は、水に溶解しない分子です。
親水性分子: 親水性分子は、水に溶ける分子です。
別名
疎水性 分子: 疎水性分子は疎水性物質と呼ばれます。
親水性分子: 親水性分子は親水性物質と呼ばれます。
水との相互作用
疎水性 分子: 疎水性分子は水分子をはじきます。
親水性分子: 親水性分子は水分子を引き付けます。
極性
疎水性 分子: 疎水性分子は無極性です。
親水性分子: 親水性分子は極性があります。
ギブスの自由エネルギー
疎水性 分子: 疎水性分子が水に追加されると、ギブスの自由エネルギーは正の値になります。
親水性分子: 親水性分子が水に追加されると、ギブスの自由エネルギーは負の値になります。
エントロピーの変化
疎水性 分子: 疎水性分子が水に追加されると、エントロピーが減少します。
親水性分子: 親水性分子が水に追加されると、エントロピーが増加します。
反応の種類
疎水性 分子: 疎水性分子を水に溶解するのは吸熱反応です。
親水性分子: 親水性分子を水に溶解するのは発熱反応です。
結論
分子は、水分子に対する応答によって、疎水性分子または親水性分子に分類できます。疎水性分子は水分子をはじきます。親水性分子は水分子を引き付けます。ただし、疎水性分子と親水性分子の主な違いは、疎水性分子は非極性であるのに対し、親水性分子は極性があることです。