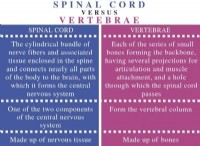
$$ n_2 + 3h_2 \ rightArrow 2nh_3 $$
方程式から、1モルのN2が3モルのH2と反応して2モルのNH3を生成することがわかります。
N2のモル質量は28 g/molです。したがって、N2の14グラムは以下に等しくなります。
$$ 14 \ text {g n} _2 \ times \ frac {1 \ text {mol n} _2} {28 \ text {g n} _2} =0.5 \ text {mol n} _2 $$
バランスの取れた化学式の化学量論によると、1モルのN2は2モルのNH3を生成します。したがって、0.5モルのN2が生成されます。
$$ 0.5 \ text {mol n} _2 \ times \ frac {2 \ text {mol nh} _3} {1 \ text {mol n} _2} =1 \ text {mol nh} _3 $$
したがって、14グラムのN2は1モルのNH3を生成できます。