硫黄 は周期表の 16 要素です。これらの硫黄の事実には、一般的な情報と歴史とともに、化学的および物理的データが含まれています。

硫黄周期表セル
基本的な硫黄の事実
名前: 硫黄
原子番号: 16
元素記号: S
グループ: 16
期間: 3
ブロック: p
エレメント ファミリー: 非金属
原子質量: [32.059; 32.076]
マグネシウム サンプルの物理的および化学的履歴を反映するための IUPAC ガイドライン。原子質量の単一の値が必要な場合は、32.066 を使用してください。
電子配置: [Ne]3s3p (略記)または 1s2s2p3s3p(フル)
発見: 古代
人々は古代から硫黄について知っていました。これは、ネイティブ形式で見つけることができる数少ない要素の 1 つです。硫黄は、多くの名前で知られています:sufra (黄色を表すアラビア語)、ブリムストーン、shulbari (サンスクリット語で「銅の敵」)、およびスルフリウム (ラテン語)。 1789 年にフランスの化学者アントワーヌ ラヴォアジエによって元素として認識されました。
名前の由来: 硫黄は、スルファリウムのラテン語の綴りから取られました。硫黄は金属ではないため、接尾辞の -ium は削除されました。
スペル: 硫黄の f は、1990 年に IUPAC によって正式に採用されました。硫黄は、19 世紀から英国の化学者によって使用されていました。 1992 年に、王立協会は英国のスペルを硫黄に正式化しました。
同位体:
天然硫黄 は、S、S、S、および S の 4 つの安定同位体で構成されています。S から S までの 21 の放射性同位体が存在します。
S
硫黄 32 は、16 個の中性子を含む安定同位体です。天然硫黄の 95.02% は硫黄 32 です。
S
硫黄 33 は、17 個の中性子を含む安定同位体です。天然硫黄の 0.75% は硫黄-33 です。
S
Sulfur-34 は、18 個の中性子を含む安定同位体です。天然硫黄の 4.21% は硫黄-34 です。
S
Sulfur-36 は、20 個の中性子を含む安定同位体です。天然硫黄の 0.02% は硫黄-36 です。
S
Sulfur-35 は、19 個の中性子を含む放射性同位元素です。硫黄 35 は β 崩壊によって Cl に崩壊し、半減期は 87.51 日です。この同位体は微量で自然に見つかります。

硫黄の小さな結晶。クレジット:Ben Mills/パブリック ドメイン)
物理データ
密度: 2.07g/cm
融点: 388.36 K (115.21 °C, 239.38 °F)
沸点: 717.8 K (444.6 °C, 832.3 °F)
重要なポイント: 20.7 MPa で 1314 K
20ºC での状態: 固体
融合の熱: 1.727kJ/mol
気化熱: 45 kJ/mol
モル熱容量: 22.75 J/mol・K
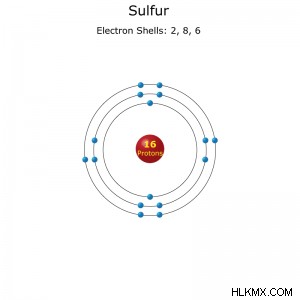
硫黄原子の電子殻配置。
原子データ
原子半径: 1.80Å
共有半径: 1.05Å
ファン デル ワールス半径: 1.80Å
電子親和力: 200.41 kJ/mol
電気陰性度: 2.58
1 イオン化エネルギー: 999.589 kJ/mol
2 イオン化エネルギー: 2251.763 kJ/mol
3 イオン化エネルギー: 3356.72 kJ/mol
4 イオン化エネルギー: 4556.231 kJ/mol
5 イオン化エネルギー: 7004.305 kJ/mol
6 イオン化エネルギー: 8495.824 kJ/mol
7 イオン化エネルギー: 27107.363 kJ/mol
8 イオン化エネルギー: 31719.56 kJ/mol
酸化状態: +6、+4、+2 (一般的)、+5、+3、+1、-1、-2 (一般的でない)

上:溶ける硫黄。溶けた液体硫黄は血のように赤い色です。下:青い炎で燃える硫黄。クレジット:Johannes Hemmerlein/GNU ライセンス
硫黄についての豆知識
- 硫黄は、天然元素として自然界に自由に存在します。
- 硫黄は溶けると赤くなります。
- 硫黄は青い炎で燃焼します。
- 硫黄は、どの元素よりも多くの同素体を持っています。同素体は 30 種類知られていますが、もろい黄色の結晶が最も一般的です。
- 硫黄はゴムの加硫に使用されます。
- 硫黄は防腐剤や抗真菌剤として使用できます。
- ほとんどの硫黄は硫酸の製造に使用されます。
- 多くの硫黄化合物は有毒です。硫化水素は嗅覚を鈍らせ、呼吸麻痺や死を引き起こす可能性があります。
- 硫黄は、蒸気を井戸に押し込むことによって塩のドームから採掘されます。蒸気が硫黄を溶かし、液体の水と硫黄が排出されます。
- もう 1 つの硫黄源は、石油精製の副産物として除去されることです。
- 硫黄にはにおいがありません。一般的に硫黄に関連する臭いは、実際には硫黄化合物によるものです。
周期表の元素の詳細をご覧ください。