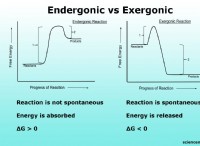
$$ 2CA(s) + o_2(g)→2cao(s)$$
方程式から、2モルのカルシウムが1モルの酸素と反応して2モルの酸化カルシウムを生成することがわかります。
まず、特定の質量のカルシウム(36.5グラム)をモルに変換する必要があります。カルシウムのモル質量は40.08 g/molです。
$$ 36.5 \ text {g ca} \ times \ frac {1 \ text {mol ca}} {40.08 \ text {g ca}} =0.910 \ text {mol ca} $$
次に、制限反応物を決定する必要があります。これを行うために、利用可能なカルシウムと酸素のモル数を比較します。
十分な酸素ガスがあると仮定すると、カルシウムのモルを使用して生成できる酸化カルシウムの最大モルを計算できます。
$$ 0.910 \ text {mol ca} \ times \ frac {2 \ text {mol cao}} {2 \ text {mol ca}} =0.910 \ text {mol cao} $$
したがって、36.5グラムのカルシウムが酸素ガスと完全に反応すると、0.910モルの酸化カルシウムが生成されます。