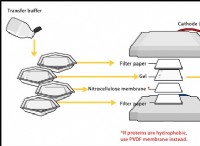
1。ブタンの燃焼のためのバランスのとれた化学式を書く:
c₄h₁₀(g) + 13/2o₂(g)→4co₂(g) + 5h₂o(g)
2。ブタンと水のモル比を決定します:
バランスの取れた方程式から、1モルのブタン(c₄h₁₀)が5モルの水(h₂o)を生成することがわかります。
3。生成された水のほくろを計算します:
5.50モルのブタンがあり、モル比は1:5であるため、生成された水のモルを計算できます。
5.50モルc₄h₁₀ *(5モルh₂o / 1モルc₄h₁₀)= 27.5モルh₂o
したがって、5.50モルのブタンが反応すると、27.5モルの水蒸気が生成されます。