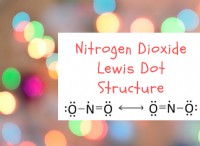
平衡の重要な特性
* 前方レートと逆レートは等しい: 反応物が産物(前方反応)に変換されている速度は、生成物が反応物に戻っている速度(逆反応)とまったく同じです。これは、反応物と生成物の量に正味の変化がないことを意味します。
* 一定濃度: 反応は続きますが、反応物と生成物の濃度は時間とともに一定のままです。
* 動的プロセス: 平衡は、反応が止まる静的状態ではありません。これは、順方向と逆の反応が同じ速度で起こっている動的なバランスであり、観察可能な変化はありません。
* 可逆反応: 平衡は、可逆的な反応でのみ可能です。これは、製品が反応して反応物を再び形成できることを意味します。
* 平衡定数(kc): 平衡時の反応物濃度に対する生成物濃度の特定の比率は、特定の温度で一定です。
例
a + b <=> c + dの反応を想像してみてください
平衡状態:
* A + BのC + Dに変わる速度は、C + DがA + Bに変わるレートと同じです。
* A、B、C、およびDの濃度は一定のままです。
重要な注意: 濃度は平衡状態で一定ですが、必ずしも等しい必要はありません。平衡状態の反応物と産物の相対量は、反応の平衡定数に依存します。