砂糖と水分子間の水素結合により、砂糖溶液は「粘着性」になります。広範な H 結合により、溶液の凝集性と接着性が向上し、その結果、粘着性が生じます。
シュガーシロップ、メープルシロップ、はちみつ、わたあめ…これらの甘い珍味にはすべて 2 つの共通点があります。
砂糖自体はただの甘い結晶で、水もべたつかないのに、なぜ水と砂糖を組み合わせるとねばねばしたねばねばした塊ができるのでしょうか?
これらの一見ありふれた物質が混ざり合ったときにどのように完全に変化するかを見つけるために、それらの分子構造を深く掘り下げる必要があります.

砂糖液がねばねば!
砂糖と水を詳しく見る
砂糖の構造
「砂糖」は、多くの異なる炭水化物を表すために使用される包括的な用語ですが、ここでは、私たち自身の「テーブル シュガー」、別名「スクロース」を指すためにこの用語を使用しましょう.
スクロースは、炭素、水素、および酸素原子でできているため、炭水化物と呼ばれる分子のクラスに属します。 12 個の炭素、22 個の水素、および 11 個の酸素原子で構成されているため、化学式は C12H22O11 です。 .
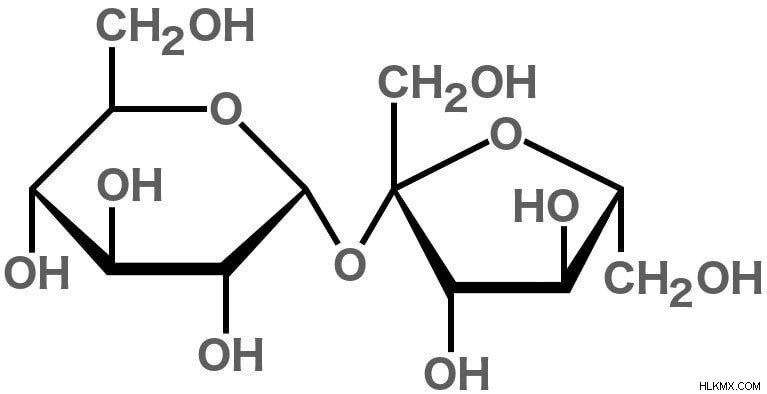
スクロース (C12H22O11
スクロースは「二糖」と見なされます ' 2 つの単糖 (単糖) が結合して形成されるため、グルコース とフルクトース .
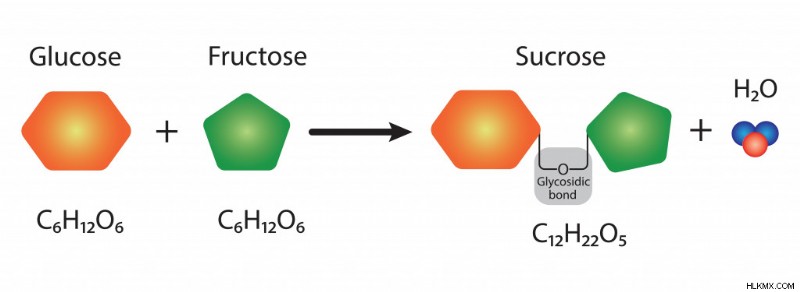
グルコースとフルクトースがグリコシド結合を介して結合し、スクロースを形成します (写真提供:Ali DM/Shutterstock)
水の分子
水 (H2O) は、私たちがよく知っている分子です。それは、酸素原子に共有結合した2つの水素原子で構成されています。水は単純な分子のように見えますが、その物理的および化学的性質は非常に複雑です。
水分子
2 つの構造を比較すると、水と砂糖には共通点があることがわかります。どちらもOH結合を持っています 両方の分子が共有結合によって形成されます .
これらが糖液のべたつきの主な要因です。共有結合の O-H 結合は、「水素結合」 と呼ばれるものに参加します。 これは、私たちが目撃し、恩恵を受けるすべての驚くべき特性を砂糖に提供します.
共有分子とイオン分子
すべての原子の究極の目的は、原子価殻を完全に満たすことによって得られる安定性を達成することです。この電子配置を実現するために、原子はさまざまなアプローチをとります;
- イオン結合:この結合は、電子の移動によって形成されます 原子間。予備の鉛筆を持っていない友人にあげるようなものです。一部の原子は余分な電子を他の原子に供与し、他の原子はこれらを受け入れて安定性を達成し、塩などのイオン分子を形成します。

イオン結合 vs 共有結合 (写真提供:Designua/Shutterstock)
- 共有結合:この結合は、電子の共有によって形成されます 原子間。この場合、2 つの結合原子が 1 対の電子を共有するため、糖と水などの共有分子が形成されます。

共有結合における電子の共有
イオン分子と共有結合分子は水中で異なる振る舞いをします:
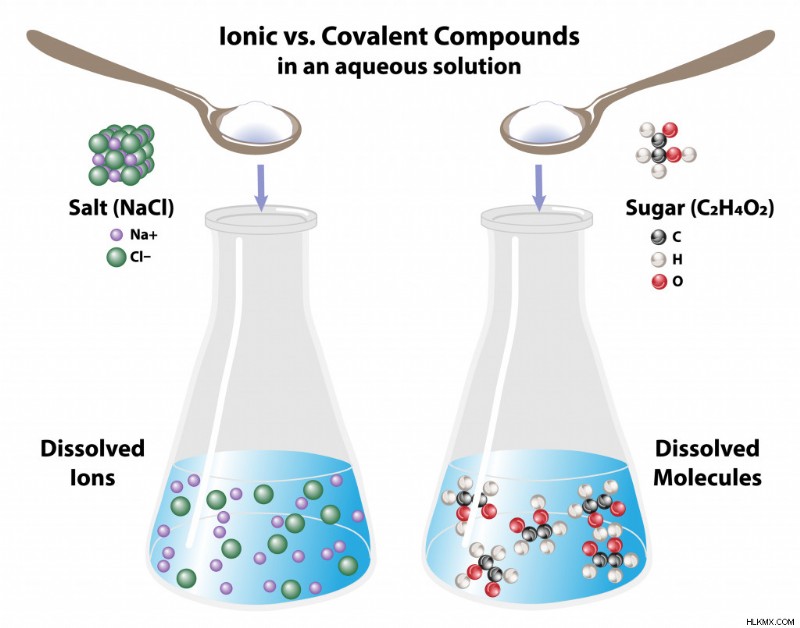
水中の砂糖と塩 (写真提供:OSweetNature/Shutterstock)
砂糖のような共有結合分子は水に溶けても分子のままですが、塩のようなイオン分子はそれぞれのイオンに解離します。
水素結合とは?
共有結合では、電子は原子間で均等に共有されません。結合は綱引きに似ており、強い方が勝ちます。酸素、窒素、フッ素などの一部の原子は、非常に 電気陰性 です。 つまり、電子を引き寄せる力があるということです。その結果、債券では、一方の端が他方よりも負になります。
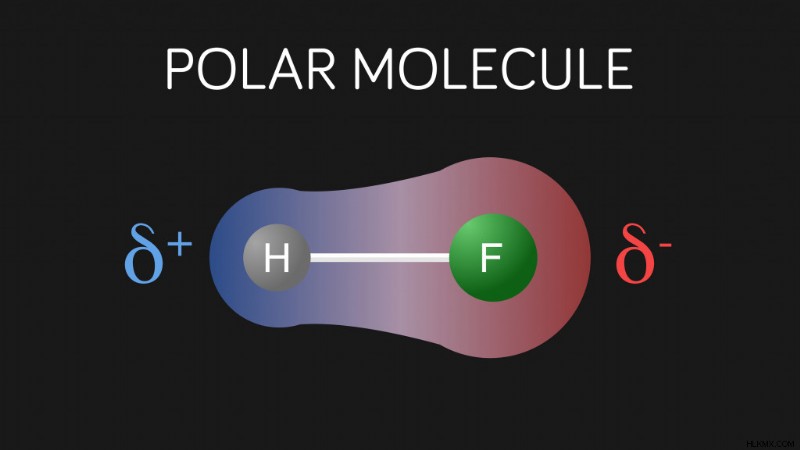
フッ素と水素の極性共有結合 (写真提供:aiyoshi597/Shutterstock)
酸素の電気陰性度は 3.44 ですが、水素の電気陰性度は 2.20 です。したがって、酸素は電子対をより強く引き寄せます。したがって、OH結合では、酸素は部分的に負の電荷を持ち、水素は部分的に正の電荷を持ちます。 1 つの分子の部分的に正の H 原子は、他の分子の部分的に負の O 原子を静電的に引き付けることができます。
水素原子 (部分的に正電荷を持つ) と、O、N、または F などの別の電気陰性原子 (部分的に負電荷を持つ) の間のこの分子間引力は、水素結合と呼ばれます。名前が示すように、これは厳密には「結合」ではなく、極性分子間の引力です。水素結合は共有結合よりも弱いですが、分子間力としてはかなり強力です.
しかし、これは粘着性と何の関係があるのでしょうか?
砂糖水の粘り気
水と砂糖自体は、2 つの理由でべとべとになりません。
結合原子の数が少なく (2 水素、1 酸素)、水分子のサイズが小さいため、液体水中の水素結合は弱いです。これらの水素結合は、水分子をあまり強く保持しません。その結果、分子は液体状態で簡単に互いに通り過ぎることができます。これが、水がどんな表面にも簡単に移動し、楽に流れる理由です。
水と比較して、スクロースはかさばる分子です。炭素鎖から突き出た 8 つの -OH グループがあります。この立体障害により、糖分子が近づきにくく、水素結合が強くなります。しかも大きいので、すれ違うのも楽ではありません。したがって、それらは積み重なり、弱い結晶構造を形成します。これが、砂糖がもろい分子結晶として存在する理由です。
ただし、水と砂糖が混ざると 、面白いことが起こります。水の中で、糖分子は広がり、自由に動きます。その上、小さな H2O 分子がスクロースの OH 鎖に近づき、水素結合を介して結合するのは非常に簡単です。したがって、砂糖と水は徐々に水素結合の広範なネットワークを形成します。その結果、ねばねばした塊になります。
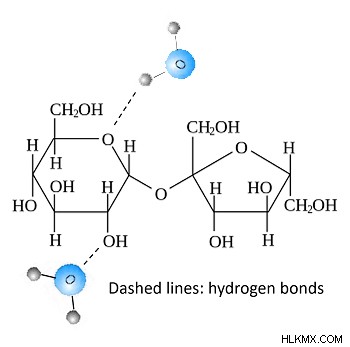
砂糖と水の水素結合
結束と接着
水素結合は、粘着性に役立つ 2 つの特性を強化します:凝集力と接着力です。
結束 「類似の」分子がくっつく傾向です。溶液中の水と水、または糖と糖の分子は、凝集によってくっつきます。また、糖の濃度が高い場合、糖分子の凝集は広範な水素結合によりエスカレートします。この結合は、スクロース鎖の形成にもつながる可能性があります。これがシュガーシロップが糸を引く理由です。わたあめは、砂糖が細い紐を形成するこの能力を利用しています。

凝集と付着により、液糖のべたつきが生じます
密着力 分子が「異なる」種類の分子にくっつく傾向です。砂糖と水の結合は接着を表します。同様に、砂糖も他の極性分子に付着する可能性があります。たとえば、私たちの皮膚は極性組織であり、砂糖も極性であるため、互いに「くっつく」ことができます.砂糖溶液が手や調理器具にくっつくのは、粘着性が原因です。
凝集力と粘着力の比率によって、物質の全体的な「粘着性」が決まります。
凝集力と接着力が高まると、溶液の流れに抵抗が生じます。 粘度と呼ばれるこの流体の抵抗は、 砂糖シロップや蜂蜜の濃厚で粘り気のある性質の原因です.
結論
これで、砂糖溶液がこんなにもべたべたした甘い混乱を引き起こす理由がわかりました.糖と水分子の間の広範な水素結合は、システムの粘着性と接着性を改善し、それによって粘着性を高めます.これで、ねばねばした砂糖溶液の背後にあるそれほど単純ではない化学が理解できました!







