
二酸化窒素 (NO2 ) は、酸素原子に単結合した中央の窒素原子と、別の酸素原子との二重結合で構成される共有結合化合物です。室温では、二酸化窒素は赤褐色の気体で、密度は 1.8 g/dm です。人体で反応し、内部構造に損傷を与える可能性のある窒素と酸素の反応種を生成する傾向があるため、人間にはわずかに有毒です.
二酸化窒素は、その比較的奇妙な電子配置のため、単一のルイス構造を持っていません。二重結合の位置は時間の経過とともに変化します。つまり、どの時点でも、酸素原子のいずれかが窒素原子と二重結合を持つ可能性があります。そのため、二酸化窒素は共鳴ルイス構造で表されます。
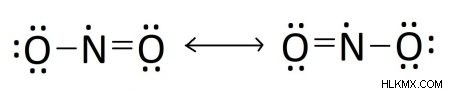
二酸化窒素は、その電子配置が 2 つの形態の間で絶えず振動するため、共鳴ルイス構造を必要とします。二酸化窒素の「真の」電子配置は、上記の 2 つの共鳴構造の平均であると考えられます。二酸化窒素のルイス構造も興味深いです。なぜなら、中心の窒素原子に不対の価電子が 1 つあるからです。不対電子を持つ化合物は、「フリーラジカル」と呼ばれることがあります。この不対電子は、この開いた電子スポットを埋めたいという強い欲求を持っているため、二酸化窒素の反応挙動を説明しています。
一歩下がって、ルイス構造を描くためのルールを見てみましょう。二酸化窒素を含むほとんどの主族化合物のルイス構造を構築する方法を段階的に見ていきます.
ルイス構造:基本
簡単に言えば、ルイス構造とは、原子または化合物の原子構造と電子配置を絵で表したものです。単一の原子は固有の化学記号で表され、電子は単一のドットで表され、電子の共有ペアは単一のペアに対して単一のダッシュ (-)、二重のペアに対して二重棒 (=)、および三重の電子対で表されます。トリプル ペアのバー (≡)。
ルイス構造の目的は、電子が原子または化合物でどのように配置されているかを確認することです。ルイス構造はオクテット規則に基づいています。これは、原子が 8 個の電子の完全な原子価殻になるまで結合を形成する傾向があるという経験的観察です。オクテット ルールの唯一の例外は水素です。これは、価電子が 2 つになるまでしか結合を形成しません。
価電子はドットのペアとして表され、各ドットは単一の電子を表します。原子は、価電子を他の原子と共有することによって共有結合を形成します。たとえば、1 つの塩素原子には 7 つの価電子があります。 3対と1つの自由電子。 2 つの塩素原子は不対電子を共有するため、各原子は電子の完全なオクテットを持ち、塩素分子 (Cl2) を形成します。 )。一般に、これが共有結合の仕組みです。各原子が完全なオクテットになるまで、原子は価電子を共有します。すべての価電子が対になっているが、原子がまだ完全なオクテットを持っていない場合、電子対は移動して二重結合と三重結合を形成します。ルイス構造の電子の総量は、個々の原子の価電子数の合計に等しくなります。
ルイス構造 は、原子または化合物の原子配列と電子分布について教えてくれます。ルイス構造だけでは分子の 3 次元形状に関する明確な情報は得られませんが、ルイス構造を記述するためのルールを分子形状を管理するルールと組み合わせて、化合物の形状を予測することができます。
ルイス構造を作るためのルール
テスト例として二酸化窒素を使用して、ルイス構造を作成するためのルールを見てみましょう。
ステップ 1. 価電子の総量を決定します。
最初のステップは、図式化する電子の数を把握することです。ルイス構造の電子の総数は、個々の原子の価電子の合計に等しくなければなりません。元素の価電子の数は、周期表のグループ番号を調べることで決定できます。一般に、第 1 族と第 2 族の元素は、それぞれ 1 個と 2 個の価電子を持っています。グループ 13-18 の元素には、それぞれ 3、4、5、6、7、および 8 個の価電子があります。グループ 3-12 の元素は、さまざまな量の価電子を持つことができる遷移金属です。
私たちの場合、二酸化窒素は 1 つの窒素原子と 2 つの酸素原子で構成されています。窒素は 15 族の元素なので 5 つの価電子を持ち、16 族の酸素は 6 つの価電子を持ちます。 2 つの酸素原子があるため、この図の価電子の合計量は次のとおりです。
5(1) + 6(2) =17 個の電子
ダイアグラムには合計 17 個の電子が含まれているはずです。
ステップ 2:化合物の原子構造をスケッチする
価電子の数がわかったので、図の作成を開始できます。化合物が 2 原子 (2 つの原子) である場合、構造は簡単です。原子を並べて配置できます。 3つ以上の原子を持つ化合物の場合、通常、末端原子と複数の結合を共有する中心原子があります。一般に、3 原子以上の化合物では、中心原子が最小の電気陰性度の元素です。
私たちの場合、三原子化合物があるので、構造にはおそらく複数の末端原子に結合した中心原子があります。窒素は酸素より電気陰性度が低い (3.04<3.44) ため、窒素が中心です。シンボルを配置すると、以下が得られます:

ステップ 3:すべての原子が少なくとも 1 つの単結合を持つように電子対を配置します
次に、モデルに電子を配置します。まず、各原子間に単結合を配置します。すべての結合は 2 個の電子としてカウントされるため、これらの電子を総量から差し引いて、残りの電子数を取得します。
この場合、次のように各原子間に 1 つずつ、2 つの単結合を配置します。
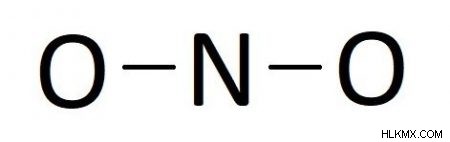
2ペア配置したので、合計4個の電子を配置しました。これで 17-4 =13 になりました より多くの電子を配置します。
ステップ 4:末端の原子から始めて、それぞれが完全なオクテットになるまで、電子対を配置します。
次に、残りの電子を配置します。末端原子から始めて、各原子が合計 8 個の価電子を持つまでドットを埋めます。残りの原子がある場合は、それらをペアで、または孤立電子として中央の原子に配置します。
最初に末端酸素から始めて、それぞれの周りに 6 個の電子を配置して、完全なオクテットを持つようにします。残った電子を窒素原子に置きます。各酸素原子に 6 個の電子を追加すると合計 12 個になるため、残りの 1 つの電子を窒素原子に配置します。
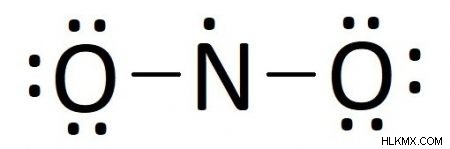
これらの 13 個の電子を配置すると、13-13 =0 個の電子になります。 置いておきます。しかし、中心原子にはまだ完全なオクテットがなく、窒素には現在 5 つの電子しかないため、まだ完了していません。 2 対と 1 つの不対電子。
ステップ 5:各原子がオクテットになるまで、またはオクテットにできるだけ近くなるまで、電子対を移動して二重結合と三重結合を形成します。
すべての電子が配置され、一部の原子がまだ完全なオクテットを持たない場合、化合物は二重結合と三重結合を形成して、すべての原子ができるだけ 8 個の電子に近づくようにします。単純に末端原子から電子対を移動させて、二重結合と三重結合を作ります。
私たちの場合、すべての電子を配置して、窒素には 5 つの価電子しかありません。結合していない電子対を酸素原子の 1 つから移動すると、窒素との二重結合が作成され、7 つの電子が与えられます。これ以上電子対を移動すると、窒素に 8 個以上の電子が与えられるため、できる限りのことを行ったので、ルイス構造は次のようになります。
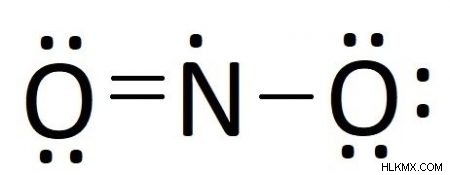
共鳴構造
ルイス図を描く最後のステップで、二重結合を作るために移動する電子対を選択する必要がありました。左の酸素原子を選択しましたが、右の酸素原子を選択して次のような結果を得ることはできませんでしたか?:

答えはイエスです。これは二酸化窒素の有効なルイス構造でもあります。ただし、この構造は前のものとは明らかに異なります。二重結合は左側ではなく右側にあります。両方のルイス構造が正当である場合、二酸化窒素の「実際の」ルイス構造はどちらですか?答えは、両方です。
化合物に複数の正当なルイス構造がある場合、ルイス構造全体が複数の構造の平均として表されます。これらの構造は共鳴構造として知られています また、電子配置が 1 つの一意のルイス図では完全に表現できない化合物に使用されます。二酸化窒素の 2 つの図の共鳴構造は次のようになります。

二酸化窒素の「実際の」構造は、2 つの図の組み合わせとして解釈されます。一部の化合物では、電子対が非局在化しているため、共鳴構造が可能です。 ある構成と別の構成の間で振動します。一部の分子の原子配置は、単一のルイス構造では正確に捉えることができないため、共鳴構造が必要です。
ルイス構造の限界
ルイス構造の規則に従うと、周期表の s ブロックと p ブロックの主族元素から作られたほとんどの化合物のルイス構造を構築できるはずです。一部の要素族は、ルイス構造を作成するための規則に常に従うとは限りません。たとえば、遷移金属は多くの場合、オクテット規則に従わず、結合して最大 12 個の価電子を得ることができます。周期表の下に行くほど、大きな元素の非常に重い原子核と強い電磁気特性のために、ルイス構造の基本的なルールが適用されなくなります。







