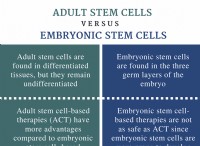
* イオン化合物: 電気は、荷電粒子(イオン)の動きによって行われます。塩化ナトリウム(NaCl)のようなイオン化合物は、溶けたときにイオンに解離し、電流の流れを可能にします。
* 共有化合物: エタン酸は共有化合物です。共有化合物は、イオン化合物のように完全に伝達するのではなく、電子を共有します。溶融状態では、エタン酸分子はそのままのままで、遊離イオンに分解しません。
* 弱酸挙動: エタン酸は酸ですが、弱酸です。これは、溶液中に部分的にしかイオン化しないことを意味します。溶液でさえ、イオンの濃度は比較的低く、その導電率が制限されます。
要約すると、その共有性と弱酸性特性のために、エタン酸は溶融状態でかなりの量の遊離イオンを形成しないため、電気の導体が貧弱です。