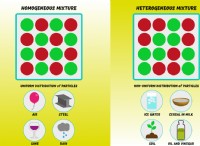
na₂s₂o₅とh₂o₂との反応:
メタ硫酸ナトリウム(na₂s₂o₅)と過酸化水素(h₂o₂)との反応は、硫酸ナトリウム(na₂So₄)、硫酸(h₂SO₄)、および水(H₂O)を産生する酸化還元反応です。
全体的なバランスの取れた化学式は:です
na₂s₂o₅ +2h₂o₂→2na₂so₄ +h₂so₄ +h₂o
メカニズム:
* 酸化: H₂o₂は酸化剤として機能し、+4から+6に酸化硫黄を酸化します。
* 削減: H₂O₂は-1から-2に減少し、水を形成します。
pH効果:
反応混合物のpHは、反応速度と生成物の形成において重要な役割を果たします。
* 酸性pH: 酸性条件では、反応が好まれ、主な生成物として硫酸が形成されます。これは、酸性環境が水へのH₂O₂の還元とnaso₅の酸化をna₂So₄に促進するためです。
* 基本的なpH: 基本的な条件では、反応が減速し、硫酸の形成が抑制されます。代わりに、硫酸ナトリウム(na₂So₃)は副産物として形成される可能性があります。
反応に影響する要因:
* 反応物の濃度: na₂o₅とh₂o₂の両方の濃度が高くなると、反応速度が増加します。
* 温度: 反応は発熱性であり、温度を上げると反応が加速します。
* 触媒の存在: 鉄やマンガンなどの特定の金属イオンは、触媒として作用し、反応を加速します。
実際のアプリケーション:
この反応は、以下を含むさまざまなアプリケーションで使用されます。
* パルプおよびペーパー産業: パルプと紙の漂白剤として使用されます。
* 水処理: 溶解した鉄とマンガンを水から除去するために使用されます。
* 食品産業: 防腐剤および抗酸化物質として使用されます。
安全上の考慮事項:
* h₂o₂は強力な酸化剤であり、火傷を引き起こす可能性があります。注意して扱います。
* na₂s₂o₅は、毒性のある二酸化硫黄ガスを放出できます。適切な換気を確保します。
* 反応は発熱性で熱を発生させることができます。適切な安全対策を使用してください。
覚えておくことが重要です: この情報は教育目的のみであり、専門的なアドバイスと見なされるべきではありません。この反応を実行する場合は、関連する安全データシートを常に相談し、適切な予防策を講じてください。