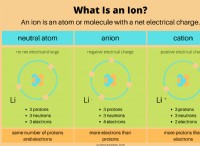
基本を理解する
* ナトリウム(Na): ナトリウムには、最も外側のシェル(価数シェル)に1つの電子があります。この電子を失い、希ガスのような安定した完全な外側のシェルを達成したいと考えています。
* 塩素(cl): 塩素には、その原子価殻に7つの電子があります。外側のシェルを完成させるために1つの電子を獲得したいと考えています。
イオン結合形成
1。電子伝達: ナトリウム原子は、その単一原子価電子を塩素原子に伝達します。
2。イオン形成:
*電子を失ったナトリウムは、今では正電荷を持ち、ナトリウムイオン(Na+)になります。
*電子を獲得した塩素は、負電荷を持ち、塩化物イオン(Cl-)になります。
3。静電引力: 反対に帯電したイオンは互いに強く惹かれ、イオン結合を形成します。
結果:塩化ナトリウム(NaCl)
得られた化合物である塩化ナトリウムは、正に帯電したナトリウムイオンと負に帯電した塩化物イオンとの間の静電引力によって一緒に保持されます。この魅力は非常に強く、塩化ナトリウムに特徴的な高融点と強い結晶構造を与えます。
視覚表現
このプロセスを次のように視覚化できます。
* na (最も外側のシェルの1つの電子) + cl (最も外側のシェルの7つの電子)
* na+ (空の外側のシェル) + cl- (完全な外側のシェル) -> nacl (イオン結合)
キーポイント
*イオン結合には、電子の伝達が含まれ、イオンの形成が生じます。
*反対に帯電したイオン間の静電引力は、イオン結合形成の背後にある駆動力です。
*イオン化合物は通常、室温で固体であり、高い融点を持っています。
他に質問がある場合はお知らせください。