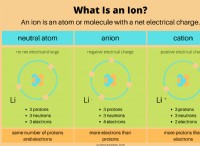
その理由は次のとおりです。
* ナトリウム(Na): ナトリウムには1つの価電子があります。 この電子を失うことにより、2つの電子の完全な外殻を持つ正の帯電イオン(Na+)になり、ネオン(NE)の電子構成を達成します。
* 塩素(cl): 塩素には7つの価電子があります。 1つの電子を獲得することにより、8電子の完全な外側シェルを備えた負に帯電したイオン(CL-)になり、アルゴン(AR)の電子構成を達成します。
これはイオン結合の一般的な傾向です。原子は、最も近い貴族の安定した電子構成を達成するために電子を獲得または失う傾向があります。この安定性は、希ガスの外側の電子殻が満たされているためであり、それらは比較的反応しません。