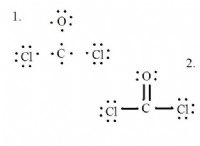* 非極性の性質: ヨウ素(I₂)は非極性分子です。これは、電子が2つのヨウ素原子間で均等に共有され、分子全体に有意な電荷の差がないことを意味します。
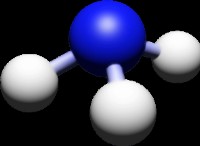
* 水の極性: 水(H₂O)は極分子です。酸素原子には部分的な負電荷があり、水素原子には部分的な正電荷があります。
* "like like dislols like": 「同様の溶解」の原理は、極性溶媒が極性溶質を溶解し、非極性溶媒が非極性溶質を溶解すると述べています。ヨウ素は非極性であり、水は極性であるため、互換性がありません。
溶解度が低いことに寄与する要因:
* 分子間力の弱い: ヨウ素分子は、弱いロンドン分散力を通じて相互作用します。水分子は強い水素結合を介して相互作用します。分子間力の違いにより、ヨウ素分子が水の構造に侵入することが困難になります。
* 限定的な相互作用: ヨウ素分子は、水分子との重要な相互作用を形成することはできず、溶解する能力を妨げます。
ただし、ヨウ素の溶解度は次のように増加させることができます
* ヨウ化イオンの存在: ヨウ素はヨウ化物イオン(I⁻)と反応して、極性の増加により水により溶けやすい三ヨード化イオン(I₃⁻)を形成できます。
* 有機溶媒の使用: ヨウ素は、ヘキサンや四塩化炭素などの非極性有機溶媒にはるかに溶けます。
要約: ヨウ素の非極性の性質と水との弱い相互作用により、水に溶けやすくなります。これは、「ような溶解のような」原理の典型的な例です。