反応物の 1 つがなくなるまで、多くの化学反応が起こります。この反応物は制限反応物として知られています。多くの場合、どの反応物が制限反応物になるかを判断するのは簡単ですが、いくつかの追加手順が必要になる場合があります.
たとえば、グリルでプロパンを燃やすことを考えてみてください。空気中のプロパンと酸素が燃焼して、熱と二酸化炭素が発生します。空気中の酸素がなくなるずっと前に、明らかにプロパンが不足する可能性が高くなります.これにより、プロパンが制限反応物になります。他の反応はそれほど簡単ではありません。
この問題例は、平衡化学方程式で与えられた反応物間の化学量論比を使用して、制限反応物を決定する方法を示しています。
制限反応物の例を見つける
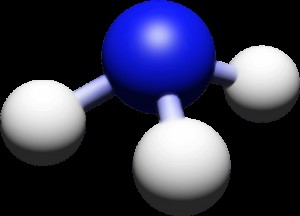
質問: アンモニア (NH3 ) は、窒素ガス (N2 ) は水素ガス (H2 ) 反応によって
N2 + 3 H2 → 2NH3
窒素ガス 50 グラムと水素ガス 10 グラムを反応させてアンモニアを生成します。 2つのガスのうち、どちらが先になくなる? (制限反応物はどのガスですか?)
答え: 反応は、N2 のすべてのモルについて私たちを示しています 消費、3 モルの H2 も消費されます。窒素ガス1モルに対して水素ガス3モルが必要です。最初に確認する必要があるのは、手元にある各ガスのモル数です。
N2 ガス: 窒素ガス50グラムは何モルですか? 1 モルの窒素は 14.007 グラムなので、1 モルの N
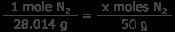
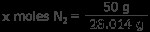
xモルN2 =1.78
H2 ガス: 水素ガス10グラムは何モルですか? 1 モルの水素は 1.008 グラムなので、1 モルの H2 は 2.016 グラムです。
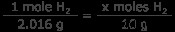
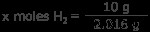
x mol H2 =4.96
これで、各反応物のモル数がわかったので、化学式からの比率を使用して量を比較できます。水素ガスと窒素ガスの比率は次のとおりです:

H2 のモルを割ると N2 のモルに 、私たちの値は、どの反応物が不足するかを教えてくれます。上記の比率より大きい値は、上部の反応物が低い数値よりも過剰であることを意味します。比率より小さい値は、上部の反応物が制限反応物であることを意味します。重要なのは、上記のステップと同じ反応物を上に置いておくことです。

2.79
私たちの値は理想的な比率よりも小さいため、一番上の反応物が制限反応物です。この場合、一番上の反応物は水素です。
答え: 水素ガスが制限反応物です。
このタイプの問題を行うときに、計算全体で同じに保つ限り、どの反応物を上に置くかは問題ではありません。水素の代わりに窒素ガスを上に置いた場合、比率は同じように機能します.理想的な比率は ⁄3 でした 計算された比率は 0.358 ( /4.96 )。値は理想的な比率よりも大きかったため、比率の下部の反応物が制限反応物になります。この場合、それは水素ガスです。







