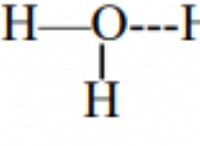電気陰性度:
* 定義: 電気陰性度は、化学結合の一部であるときに電子を自分自身に引き付ける原子の能力の尺度です。
* トレンド: 電気陰性度は一般に、期間(左から右)にわたって増加し、周期表のグループを減少させます。
極結合:
* 層: 極性結合は、有意に異なる電気陰性度を持つ2つの原子が電子を共有する場合に発生します。電気陰性度が高い原子は、共有電子をより強く引き付け、その原子に部分的な負電荷(Δ-)と他の原子に部分的な正電荷(Δ+)を生成します。
* 例: 水分子(H₂O)では、酸素は水素よりも電気陰性度が高くなっています。共有電子は、酸素原子の周りでより多くの時間を費やし、部分的な負電荷を与え、水素原子に部分的な正電荷を残します。
非極性結合:
* 層: 非極性結合は、類似または同一の電気陰性度を持つ2つの原子が電子を均等に共有する場合に発生します。 2つの原子間に電子密度に有意な差はありません。
* 例: メタン分子(Ch₄)では、炭素と水素は同様の電気陰性度を持っています。電子は炭素原子と水素原子の間でほぼ等しく共有されており、結合は非極性になります。
キーポイント:
* 電気陰性度の違い: 2つの原子間の電気陰性度の違いが大きいほど、結合の極性が高くなります。
* 極性スケール: 債券は一般的に考慮されます:
* 非極性: 電気陰性度の差が0.5未満の場合。
* 極: 電気陰性の差が0.5〜1.7の場合。
* イオン: 電気陰性の差が1.7を超える場合。 (これらは真の共有結合ではなく、むしろイオン結合です。)
要約すると、電気陰性度は化学結合の性質を決定する根本的な要因です。 2つの原子間の電気陰性度の違いは、結合内の電子の分布に直接影響し、極性または非極性特性につながります。