基本を理解する
* 水素同位体: 水素には3つの同位体があります。
* Protium(¹h): 最も一般的な、1つの陽子と中性子がない。
* 重水素(²h): 重水素とも呼ばれ、1つのプロトンと1つの中性子を備えています。
* トリチウム(³H): 1つのプロトンと2つの中性子を備えた放射性。
* 塩素: 2つの自然に発生する同位体(³⁵clおよび³⁷cl)を備えた高反応性非金属。
* 日光: 塩素分子(Cl₂)を反応性塩素原子に分割するために必要なエネルギーを提供します。
反応
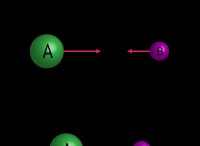
日光における水素と塩素の間の反応は、光化学反応の典型的な例です 。
1。塩素解離: 日光は塩素分子を破壊するエネルギーを提供します:
Cl₂ +日光→2 Cl
2。水素塩素反応: 塩素原子は水素分子と反応し、塩化水素(HCl)を形成します。
H₂ + Cl→HCl +H。
この反応は鎖反応です 。最初のステップで生成された水素原子は、別の塩素分子と反応し、サイクルを継続できます。
3。同位体変動: 3つの水素同位体すべてがこの反応に参加できます。
* Protium: 形成¹h-cl(塩化水素)。
* 重水素: 形成²h-cl(塩化重水素)。
* トリチウム: 形を形成しています(塩化トリチウム)。
キーポイント
* 反応率: 重水素とトリチウムは、反応速度にわずかに影響を与える可能性があるプロトウムよりも重いです。ただし、違いは通常小さいです。
* 放射能: トリチウムは放射性であり、ベータ崩壊を受けます。結果として得られる³H-CL分子も放射性になります。
* 製品形成: 3つの同位体すべてが塩化水素分子を形成し、唯一の違いは水素原子の質量です。
重要な注意: この反応は非常に発熱性であり、水素と塩素の混合物が慎重に制御されない場合、爆発する可能性があります。