モル熱容量は、物質 1 モルの温度を 1 単位上昇させるのに必要な熱量であり、熱容量を総モル数で割って計算されます。
なべを使っているときに火傷しないのはなぜだろうと思ったことはありませんか?
もちろん、私たちを守ってくれるのは取っ手ですが、鍋自体ほど熱くならないのはなぜでしょうか。結局、同じ量の熱にさらされます。
まず、鍋の取っ手は通常プラスチック製で、熱伝導率が低いことを意味します。また、同じ量の熱にさらされる場合、プラスチックハンドルの温度上昇は金属部分の温度上昇よりもはるかに少なくなります。これは、鍋が作られている金属と比較して、ハンドルの熱容量が大きいことに起因します.
熱容量は、物質の特定の質量の温度を 1 単位上昇させるのに必要な熱エネルギーの量として定義されます。比熱容量とモル熱容量は、材料の熱容量に由来する特性です。

ハンドルの熱容量が大きいため、鍋自体ほど熱くなりません (写真提供:Kzenon/Shutterstock)。
比熱とモル比熱
熱容量は広範な特性です。つまり、物質の量とサイズに依存します。熱容量の変形形式 (比熱容量または単に比熱と呼ばれる) は、物理学で一般的に使用されます。比熱は物質の量によって変化しないため、より有用な特性です。
比熱は、物質の質量 1 単位を温度 1 単位上げるのに必要な熱量として定義されます。数学的には、物質の熱容量をその質量で割ったものです。比熱の式は次のとおりです。

ここで、c は比熱で単位は J/kg.K、C は物質の熱容量 (J/K)、m は物質の質量 (キログラム) です。比熱を表すために使用されるもう 1 つの非常に重要な式は次のとおりです。
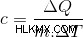
ここでも、c は比熱を表し、ΔQ はジュール単位の熱エネルギーの差、m は物質の質量、ΔT はケルビン単位の温度差です。
化学では、通常、物質の量はグラムではなくモルで測定されますが、熱容量の定義と式をさらに変更してモルを含めると、作業がはるかに簡単になります。
モル熱容量は、物質 1 モルを 1 ケルビン上げるのに必要な熱量として定義されます。比熱と同様に、モル熱容量は集中的な特性です。つまり、違います。 物質の量によって異なります。
数学的には、物質の熱容量をモル数で割ったもので、次のように表されます。
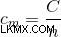
ここで、cm はモル熱容量 (J/K.mol)、C は熱容量 (J/K)、n はモル数 (mol) です。
比熱とモル熱容量は、物質の量やサイズによって変化しない場合がありますが、それらの値は測定方法に基づいて変動します。
熱エネルギーが物質、特に気体に供給されると、温度上昇に伴って体積または圧力が増加し、場合によってはその両方が増加します。これらの現象は、シャルルの法則とゲイ・リュサックの法則によって説明されます。
CP,m &CV,m は、一定圧力 (等圧) および一定体積 (等容) で測定されたモル熱容量を表すためによく使用されます。
一定圧力でのモル比熱の値は、一定体積で測定した値よりも常に大きくなります。これは、一定の圧力で供給された熱が仕事を生み出すために使用され、体積も膨張するためです。対照的に、一定量で供給される熱は、物質の温度を上昇させるためにすべて利用されます。
CP と CV の比は、熱容量比または断熱指数 (γ =CP/CV) と呼ばれ、熱力学で可逆過程を扱う場合に重要な用語です。一方、CP,m と CV,m の差は、普遍気体定数 R に等しくなります。式 CP,m – CV,m =R は Mayer の関係と呼ばれます。
物質のモル熱容量を計算する方法
物質の熱容量を決定し、それに続いてその比熱とモル熱容量を決定することは、正確にはロケット科学ではありません。これらの値は、単に定義を分解し、個々の量 (供給または除去される熱の量、初期温度、最終温度、質量、および物質のモル数) を見つけ、それらをそれぞれの場所に代入することによって計算できます。
ステップ 1:熱容量を見つける
すでに定義したように、熱容量は、既知量の物質の温度を 1 単位上昇させるのに必要な熱量です。定義は次のように表されます:
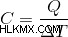
ここで、C は熱容量、Q は熱エネルギー、ΔT は温度差です。 ΔQ は Q を置き換えることもできます。
ΔT は T1-T2 であり、T1 は物質の初期温度、T2 は物質の最終温度です。温度計を使用して初期/開始温度 T1 を書き留めることから始めます。また、後で使用できるように、サンプルの重量を量り (m)、kg で記録します。
次に、既知の量の熱エネルギー (Q) をシステムに供給します。熱エネルギーの量は、ジュールまたはカロリーで表示できます。熱の供給が完了したら、温度が安定するまで待ち、最終温度を T2 として記録します。
数値 273.15 を摂氏の値に追加して、温度の値をケルビンに変換します (0°c =273.15 K)。供給される熱エネルギーの値がカロリーで利用できる場合は、ジュールに変換します。カロリー単位の熱エネルギー量に 4.184 を掛けると、ジュール単位の量が得られます (1 カロリー =4.184 ジュール)。
最後に、Q、T1、および T2 の値を熱容量式に代入します。電卓をつかむか、脳を使って計算を実行し、サンプルの熱容量を取得します。熱容量の単位は J/K です。
ステップ 2:比熱容量または比熱を求める
比熱容量または比熱は、サンプルの熱容量をその質量で割ることによって簡単に見つけることができます (c =C/m)。前のステップで見つけた C の値を前のステップでメモした m の値で割り、サンプルの比熱を求めます。結果の量の単位は J/kg.K
になります。ステップ 3:モル熱容量の決定
上にスクロールしてモル熱容量 (cm=C/n) の式を見ると、サンプルのモル数を表す用語「n」が見つかります。モル数を求めるには、サンプルの量をそのモル質量で割ります。


n がわかったので、式に熱容量 (C) の値とモル数 (n) を代入し、モル熱容量を計算します。
モル熱容量を決定する別の方法は、サンプルの比熱 (c) にそのモル質量 (M) を掛けることです。これを行うときは、必ずモル質量を kg/mol に変換してください。

代替方法 – 熱量計の使用
物質の比熱を決定する別の方法は、熱量計の使用です。熱量計は、内槽と外槽、攪拌機、温度計、断熱材などで構成される科学機器です。
内側の容器またはカップには、比熱を測定するサンプル材料が含まれています。水で満たされた外側の容器の真ん中に置かれます。
この手順は、水とサンプル物質の両方の質量と初期温度を記録することから始まります。
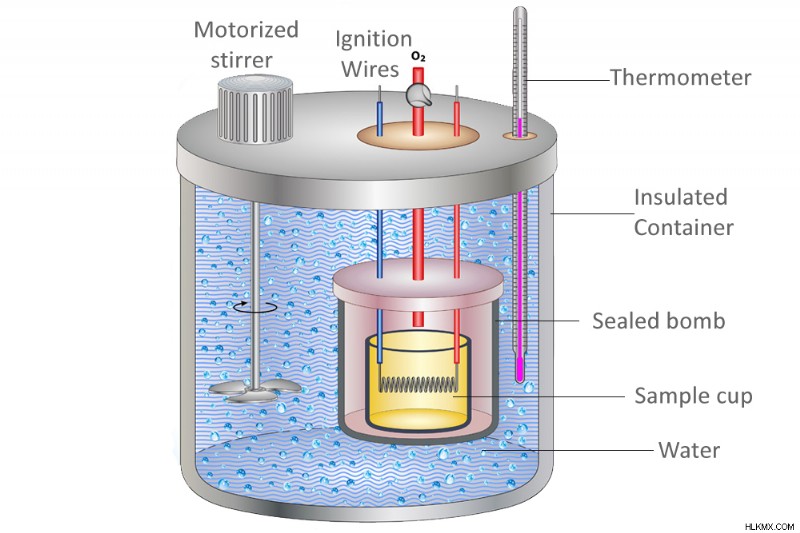
熱量計は、反応における熱の流れを測定するために使用されます。この技術は熱量測定と呼ばれます。 (写真提供:Fouad A. Saad/Shutterstock)
次に、サンプルは点火ワイヤーを使用して加熱されます。サンプルの温度が外部の水の温度を超えると、2 つの間の熱伝達が始まります。しばらくして電気の流れを止め、水とサンプルの最終温度を測定します。サンプル材料によって失われる熱エネルギーは、外側の容器内の水によって得られる熱に等しくなります。ここで、式 ΔQ =mcΔT を使用します。
サンプルの場合、ΔQs=(mcΔT)s、水の場合、ΔQw=(mcΔT)w.
ただし、ΔQs =ΔQw です。したがって、(mcΔT)s =(mcΔT)w.
サンプルと水の質量 (それぞれ ms と mw)、温度の変化 (ΔTs =T1s-T2s と ΔTw =T1w-T2w)、水の比熱 (cw) を 4.1796 kJ として代入します。 /kg.K を使用して、サンプルの比熱 (cs) を決定します。物質の比熱が判明したら、それにモル質量を掛けると、物質のモル熱容量が得られます。
熱容量の応用
物質の熱容量は、いつどこで使用できるかを決定します。たとえば、調理器具のハンドルとハンドルは、ユーザーの安全を確保するために熱容量の高い素材で製造されています。一方、温度計は比熱容量の小さい材料で製造されているため、わずかな温度変動でも検出できます。
この別の例は、エンジン冷却システムでの水の使用です。水はすべての液体の中で最大の比熱容量を持っています。同じ熱量の場合、水温の上昇が最小限に抑えられるため、冷却液/冷却剤として理想的です。
夏の暑い日に、海水が太陽から同じ量の熱にさらされていても、周囲の空気や砂よりも冷たいままであるという現象は、熱容量の概念によっても説明できます。水の高い熱容量地球の気候や水生生物の生存など、多くの自然現象に関与しています!












