概念を理解する
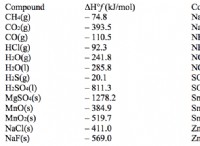
* エンタルピー変化(ΔH): これは、反応中に吸収または放出される熱を測定します。陽性ΔHは、反応が吸熱であることを意味します(熱を吸収します)。
* エントロピー変化(ΔS): これにより、システムの障害またはランダム性の変化が測定されます。陽性ΔSは、産物が反応物よりも乱れていることを意味します。
* ギブス自由エネルギー(ΔG): これにより、反応の自発性が決定されます。負のΔGは自発的な反応を示しますが、陽性ΔGは非同様の反応を示します。
方程式
これらの要因間の関係は、ギブスの自由エネルギー方程式によって要約されています。
Δg=Δh -tΔS
どこ:
* tはケルビンの温度です。
陽性ΔHとΔSが自発性につながる方法
* 吸熱反応: 正のΔHは、反応が周囲から熱を吸収することを意味します。これにより、より低い温度では反応が好ましくなりません。
* 障害の増加: 陽性ΔSは、産物が反応物よりも乱れていることを意味します。これは、システムのランダム性を高めるため、自発性を支持します。
重要な要因:温度
* 高温: 高温では、ギブス自由エネルギー方程式のTΔS項が支配的になります。 TΔSが陽性ΔHを克服するのに十分な大きさの場合、全体のΔGが陰性になり、反応が自発的になります。
要約
陽性ΔH(吸熱)と陽性ΔS(障害の増加)を伴う化学反応は、次の状態では自発的になる可能性があります。
* 十分に高温で: エントロピー項(TδS)の増加は、吸熱エンタルピー変化(ΔH)を上回り、反応を自発的にする可能性があります。
例
氷の融解は吸熱プロセス(陽性ΔH)であり、障害の増加(陽性ΔS)につながります。氷の融解は、より高い温度によって駆動されるエントロピーの増加がプロセスの吸熱性を克服するため、凍結点(0°Cまたは273 K)を超える温度で自発的です。