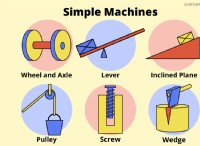
* カルシウム(Ca) 周期表のグループ2の金属であり、2つの原子価電子を備えています。安定した高貴なガスの構成を実現するために、これらの電子を *失う *傾向があります。
* 硫黄 グループ16の非金属であり、6つの価電子を備えています。安定した高貴なガス構成を実現するために、2つの電子を *獲得する傾向があります。
カルシウムと硫黄が反応すると、カルシウムは2つの原子価電子を失い、正に帯電したイオン(ca²⁺)になります。硫黄はこれら2つの電子を獲得し、負に帯電したイオン(s²⁻)になります。これらの反対に帯電したイオンは、互いに静電的に惹かれ、イオン結合を形成します。
得られた化合物である硫化カルシウムは、イオン化合物に典型的な融点が高い固体です。