過飽和説明:
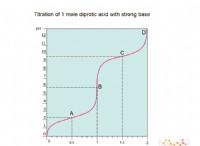
* 溶解度: すべての物質には、特定の温度で特定の溶媒(水など)に溶解できる金額に制限があります。この制限は、その溶解度と呼ばれます。
* 過飽和: 過飽和溶液は、特定の温度での溶解度制限よりも *溶質を *溶質に保持します。これは不安定な状態です。ソリューションは不安定であり、通常の飽和状態に戻りたいと考えています。
* 結晶化のトリガー: わずかな妨害でさえ、過飽和溶液で結晶化を引き起こす可能性があります。これは、種子の結晶を追加したり、容器を揺さぶったり、温度の変化を加えたりする可能性があります。
チオ硫酸ナトリウムを追加する理由は結晶化を引き起こす理由:
1。過剰溶質: チオ硫酸ナトリウムを追加すると、溶液中の溶質の濃度が増加します。これにより、ソリューションは溶解度の制限をさらに超えます。
2。核生成部位: 追加されたチオ硫酸ナトリウム自体は、核形成部位として作用する可能性があります。 これらは、溶質分子が一緒に凝集し始め、結晶構造を形成することができる小さな点です。
3。鎖反応: いくつかの結晶が形成されると、それらはさらなる結晶化のために種として作用します。 これらの結晶の存在により、より多くの溶質分子がそれらに付着し、結晶を成長させることが容易になります。
要するに すでに飽和したソリューションにチオ硫酸ナトリウムを追加すると、不安定性を克服し、結晶化プロセスを引き起こすために必要な「余分なプッシュ」が得られます。 核生成部位として作用する過剰溶質と追加されたチオ硫酸ナトリウムは、結晶層のカスケードを開始します。