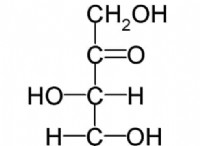
1。ハイブリダイゼーション: アンモニウム中の窒素原子は、SP³ハイブリダイゼーションを受けます。これは、窒素混合の2S軌道と3つの2p軌道が4つの等価Sp³ハイブリッド軌道を形成することを意味します。これらの軌道は、窒素原子の周りに四面体に配置されています。
2。孤立ペア: その基底状態の窒素には、5つの価電子があります。アンモニウムでは、窒素は、すべての原子価電子を使用して、4つの水素原子を持つ4つの共有結合を形成します。 ただし、窒素には依然として電子の唯一のペアがありますが、結合構造には存在しないため、形状に影響しません。
3。反発: それぞれが孤立したペアを含む4つのSp³ハイブリッド軌道には、四面体形状に配置された場合、最大の反発が発生します。これは、この配置が結合ペア間の電子電子反発を最小化し、安定したエネルギーと低エネルギーの構成をもたらすためです。
4。 vSEPR理論: 価数シェル電子ペア反発(VSEPR)理論は、中心原子の周りの電子ペア数に基づいて分子のジオメトリを予測します。アンモニウムの場合、窒素原子の周りに4つの電子ペア(4つの結合ペア)があり、四面体の配置につながります。
したがって、窒素のハイブリダイゼーション、孤立したペア、および電子ペア間の反発により、アンモニウムは四面体の形状を示します。