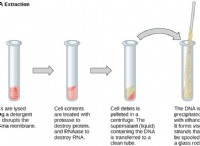
1。アクティブサイトへの基質の結合:
* 特異性: 各酵素には、特定の形状と化学環境を備えた3次元ポケット、独自のアクティブサイトがあります。この部位は、基質と呼ばれる特定の分子に結合するように設計されています。
* 誘導フィットモデル: 酵素と基質は、最初は完全に合うものではありません。基板が結合すると、アクティブサイトは形状をわずかに変化させて、手袋が手に適応するように、基板をよりぴったりとフィットします。この誘導フィットは、反応に最適に基質を配置するのに役立ちます。
2。遷移状態の形成:
* 活性化エネルギーの低下: 酵素は、活性化エネルギーを低下させることにより反応を促進します。これは、反応が開始するために必要なエネルギーです。これは、反応が発生するために到達する必要がある不安定な高エネルギーの中間体である遷移状態を安定化することによって行われます。
* 安定化: 酵素はさまざまなメカニズムを使用して活性化エネルギーを低下させます。
* 近接性と向き: 活性部位は、反応のために正しい方向で基質分子を互いに近づけます。
* ひずみ: アクティブサイトは基板にストレスをかけ、その結合を歪め、壊れやすくすることができます。
* 酸塩基触媒: 酵素残基は、結合を破壊または形成するのに役立つ陽子(H+)を寄付または受け入れることができます。
* 共有触媒: 酵素は、基質と一時的な共有結合を形成し、結合の破壊と形成を促進することができます。
3。製品のリリース:
* 製品形成: 遷移状態に到達すると、反応は迅速に進行し、製品が形成されます。
* 製品リリース: 酵素は、その活性部位から製品を放出します。酵素は、別の基質を結合し、反応を再び触媒する準備ができています。
要約:
*酵素は、化学反応を高速化する非常に特異的で効率的な触媒です。
*彼らは、主に遷移状態を安定化することにより、活性化エネルギーを下げることにより、これを達成します。
*この安定化には、近接、ひずみ、酸塩基触媒、共有触媒などのさまざまなメカニズムが含まれます。
*酵素はプロセス全体で変化しないままであり、複数の反応に再利用できます。
例:
* ラクターゼ: 乳糖(乳糖)をよりシンプルな糖に分解します。
* DNAポリメラーゼ: 細胞分裂中にDNAをコピーします。
* ペプシン: 胃のタンパク質を分解します。
注: 酵素は非常に効率的ですが、それらの活性は、温度、pH、阻害剤の存在などの要因に影響を与える可能性があります。