反応物の総質量数は、製品の総質量数に等しくなります。
これがどのように機能しますか:
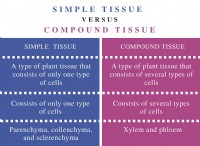
* 質量数: 原子の質量数は、その陽子と中性子の合計です。
* 化学反応: 化学反応では、原子は再配置され、作成または破壊されません。各原子の陽子と中性子の数は同じままです。
* 保存: これは、方程式の反応物側の陽子と中性子の総数が製品側の総数に等しくなければならないことを意味します。
例:
メタンの燃焼(Ch₄)を考慮してください。
ch₄ +2o₂→co₂ +2h₂o
* 反応物:
*ch₄:質量数=12(c) + 4(h)=16
*2o₂:質量数=2 * 32(o)=64
*総反応物質量=16 + 64 =80
* 製品:
*co₂:質量数=12(c) + 2 * 16(o)=44
*2h₂o:質量数=2 *(2(h) + 16(o))=36
*総製品質量数=44 + 36 =80
反応物側の総質量数(80)は、製品側の総質量数に等しくなります(80)。したがって、質量数の保存の原理は、この化学式で満たされています。
キーポイント:
*質量数の保存の原理は、核の保存としても知られています 。
*この原則が核反応に当てはまることを覚えておくことが重要です 同様に、プロトンと中性子の数が変化する可能性がある場合。
*化学式のバランスをとると、質量数の保存が保証されます。
さらに質問がある場合はお知らせください!